(c) Phage therapy
Прошел 91 год со дня открытия пенициллина — первого препарата, совершившего революцию в эффективности лечения бактериальных заболеваний.
За почти век существования антибактериальных препаратов многие болезни практически забылись. Так, с 1947 г. считается, что Yersinia pestis, чумную бактерию, виновницу смерти 150 млн человек, удалось победить. И главным средством первого этапа лечения стали антибиотики.
Однако из-за роста вероятности возвращения забытых и появления новых инфекционных заболеваний Всемирная организация здравоохранения в последнее десятилетие бьет в набат. Причинами катастрофы стали халатность, глупость и эволюция. Скоро даже обычный порез на пальце может закончиться смертью. Но на подходе новые методы борьбы.
Первые проблемы
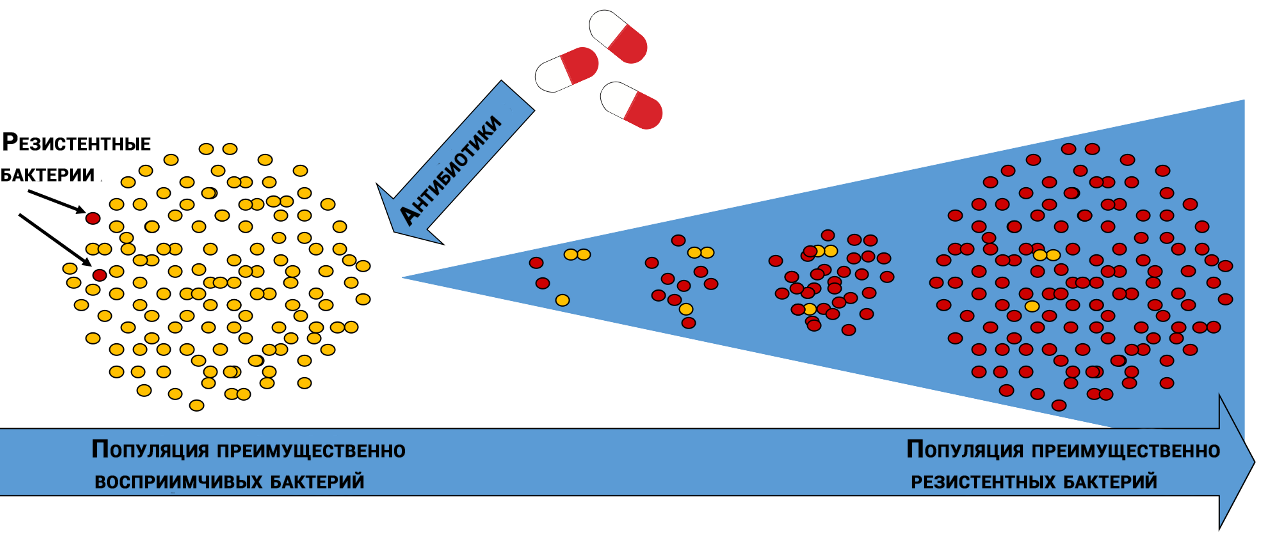
Естественный отбор антибиотикоустойчивых бактерий
У разных популяций бактерий молекулы, на которые действуют антибиотики, имеют разную «чувствительность». Кроме того, бактерии одного и того же вида могут отличаться друг от друга, как снежинки — через многообразие жизнь всегда находит себе дорогу.
Случайным образом некоторые бактерии оказываются менее восприимчивы к действию антибиотика, и часть бактерий, уцелевшая после геноцида, даст потомство, которое вырастет и погибнет, но успеет оставить свое потомство, которое через ряд поколений создаст «идеальную» популяцию.
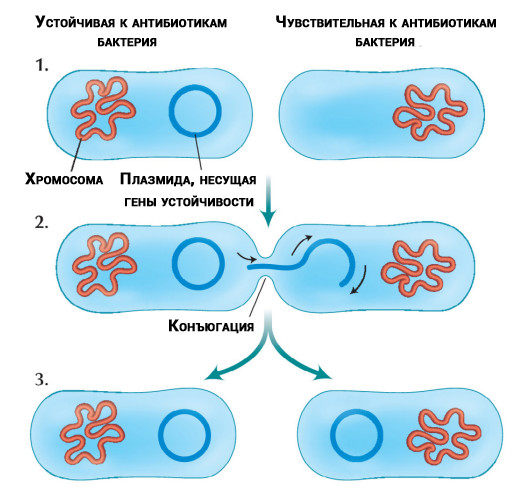
Перенос обособленных от хромосом молекул ДНК (плазмид), устойчивых к антибиотикам, между бактериями
Беда не приходит одна. Исследователи обнаружили, что некоторые бактерии могут передавать гены устойчивости другим бактериям как того же вида, так и другого. Перенос происходит независимо от того, присутствуют ли в лечении антибиотики или нет.
C момента открытия пенициллина чрезмерное использование антибиотиков существенно повлияло на развитие резистентности бактерий — невосприимчивости к антимикробным препаратам, что привело к появлению неизлечимых суперинфекций.
Перешагнуть Рубикон
Для снижения распространения резистентности к противомикробным препаратам в настоящее время используется инструмент AWaRe (Access, Watch and Reserve), разработанный экспертами ВОЗ в виде списка основных эффективных лекарственных средств.
В данном списке антибиотики разделяются на три группы: Access (доступность, препараты первого выбора), Watch (бдительность) и Reserve (резерв). Здесь определяется, какие антибиотики следует использовать лишь для конкретных бактерий, вызывающих наиболее распространенные заболевания, какие значительно увеличивают риск возникновения устойчивости, и какие необходимо применять в крайних случаях, при инфекциях с множественной устойчивостью.
На практике алгоритм действует следующим образом. В стерильный флакон набирают выделения из организма пациента (гной, раневое отделяемое, соскоб с бронха и т.д.) и отправляют в бактериологическую лабораторию, где определяют, какая именно бактерия находилась в материале, к каким антибиотикам она чувствительна, а к каким — устойчива.
Если бактерия не чувствительна к антибиотикам первой линии, врачи обращаются к менее используемым препаратам. Часть из них всегда должна быть в запасе и не применяться там, где могут справиться другие лекарства. Соответственно, и микроорганизмы меньше с ними знакомы и пока еще чувствительны.
По иронии судьбы среди антибиотиков резерва есть препараты, получаемые из самих бактерий. Например, колистин, произведенный в 1949 г., получен из бактерии Paenibacillus polymyxa. Этот антибиотик, как и другие из группы последнего резерва, применялся, как считалось, редко. Однако в 2015 г. нашлись резистентные к колистину бактерии.
Более 100 стран разработали национальные планы по борьбе с устойчивостью к противомикробным препаратам, но из них 75 % не имеют средств или мотивации для финансирования плана надлежащего применения антибиотиков.
В частности, Китай, невзирая на международные рекомендации, использовал 12 тыс. тонн колистина (препарат резерва) в год для откорма свиней и предотвращения болезней у других животных.
При отсутствии ясного понимания, для чего необходим тотальный контроль распространения устойчивости к противомикробным препаратам, на помощь исследователям по всему миру приходит математика, которая позволяет моделировать различные ситуации и просчитывать риски развития резистентности, вплоть до фатальных. Наука с бессердечной точностью показывает, что грозит миру.
Фармацевтическое фиаско
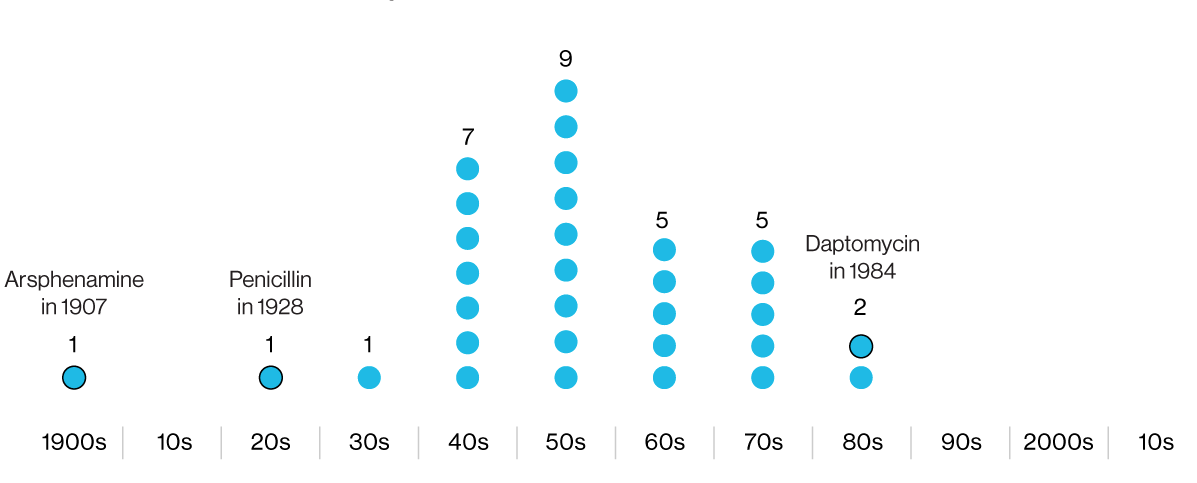
В инфографике указаны годы разработки антибиотиков, впоследствии веденных в клиническую практику. Первый — арсфенамин — опасный мышьяксодержащий противомикробный химикат. Последний — даптомицин — утратил эффективность против некоторых штаммов MRSA.
После пенициллиновой революции на полях сражений во время Второй мировой войны фармацевтическая промышленность вступила в «золотую эру» антибиотиков. Компании нанимали исследователей, миссионеров и путешественников со всего мира, чтобы собирать образцы почв в поисках новых антибактериальных соединений. Но «золотой век» стремительно сошел на нет, и в 1980-х годах настала «зима антибиотиков», которая продолжается до сих пор.
Сегодня разработка принципиально новых антибиотиков — редчайшее событие. Из полусотни препаратов, находящихся на разных стадиях клинических испытаний, менее дюжины действительно инновационны.
Инвесторы руководствуются логикой, а не эмоциями: стоимость таких препаратов трудно повысить, так как общественность может возмутиться, и рассчитывать на регулярные поставки не стоит — по той причине, что препарат может попасть в резерв.
К тому же, потратив годы на поиск нового вещества и клинические исследования эффективности и безопасности, фармацевтические компании рискуют уже через месяцы после выхода на рынок «поймать» резистентность.
Из всех проверенных в двойных слепых плацебо контролируемых рандомизированных исследованиях за последние годы одобрили только восемь антибиотиков или их комбинаций: делафлоксацин, меропенем + ваборбактам, озеноксацин, плазомицин, эравациклин, имипенем + циластатин + релебактам, лефамулин.
Лефамулин, выпускаемый под брендом «Ксенлента», стал первым одобренным за 20 лет препаратом с новым механизмом действия против внебольничной бактериальной пневмонии. Показательно, что от безусловного медицинского триумфа производитель может ничего не получить.
Подобное уже случалось. Так, компания Achaogen, потратив $250 млн, на протяжении 15 лет пыталась вывести на рынок новый антибиотик — плазомицин, после чего скоропостижно обанкротилась.
Учитывая актуальность проблемы, другие исследователи ищут новые прагматичные подходы в разработке методов сдерживания бактериального роста.
Всадники оптимизма

Стартап разработал платформу для перепрограммирования бактерий на генетическом биопринтере, печатающем фрагменты ДНК длиной до 10 тыс. пар оснований.
Бостонская биотехнологическая компания Ginkgo Bioworks, поддержанная американским военным ведомством DARPA и венчурным фондом Y Combinator, вместо более эффективных антибиотиков создает на биопринтере пробиотики — полезные бактерии, нацеленные на борьбу с «конкурирующими» резистентными микроорганизмами.
Не менее впечатляющий продукт разрабатывают специалисты Locus Biosciences, взяв на вооружение метод редактирования генов CRISPR Cas3. Технология CRISPR известна благодаря использованию фермента Cas9, действующего как «генетические ножницы» для вырезания, редактирования и замены фрагментов ДНК.
Cas3 превосходит Cas9 широтой охвата — он способен влиять на длинные участки ДНК. CRISPR Cas3 целенаправленно воздействует на бактерии и вирусы, и не просто режет, а эффективно стирает определенные последовательности ДНК — до 100 тыс. пар нуклеотидов за один раз.
В Locus Biosciences планируют использовать данную технологию для борьбы с опасными бактериями. В пользу метода играют большие размеры фермента Cas3 — он действует на бактериальные клетки, но слишком велик для проникновения в человеческую клетку и повреждения нашей ДНК.
Статью, наполненную смертью и разочарованием, хочется закончить на мажорной ноте. Мы не одиноки в борьбе с бактериями. Миллиарды лет вирусы-бактериофаги оставались одним из наиболее мощных инструментов контроля микробных популяций, но были почти не изучены на фоне успеха антибиотиков.
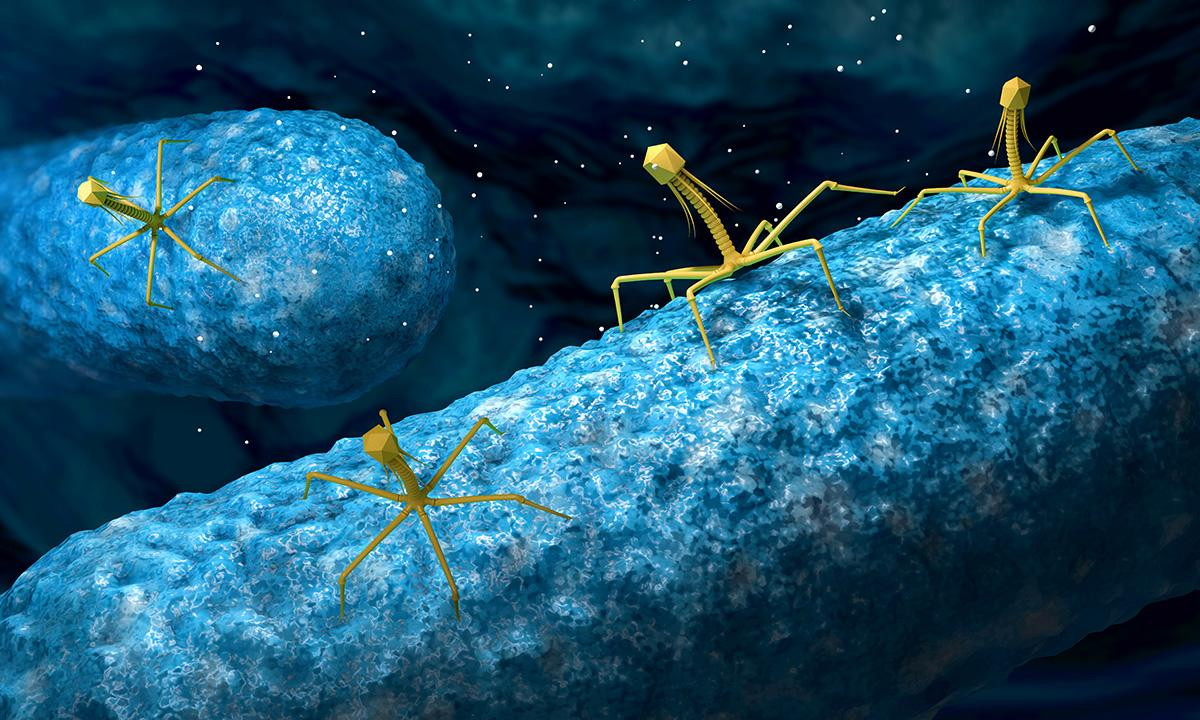
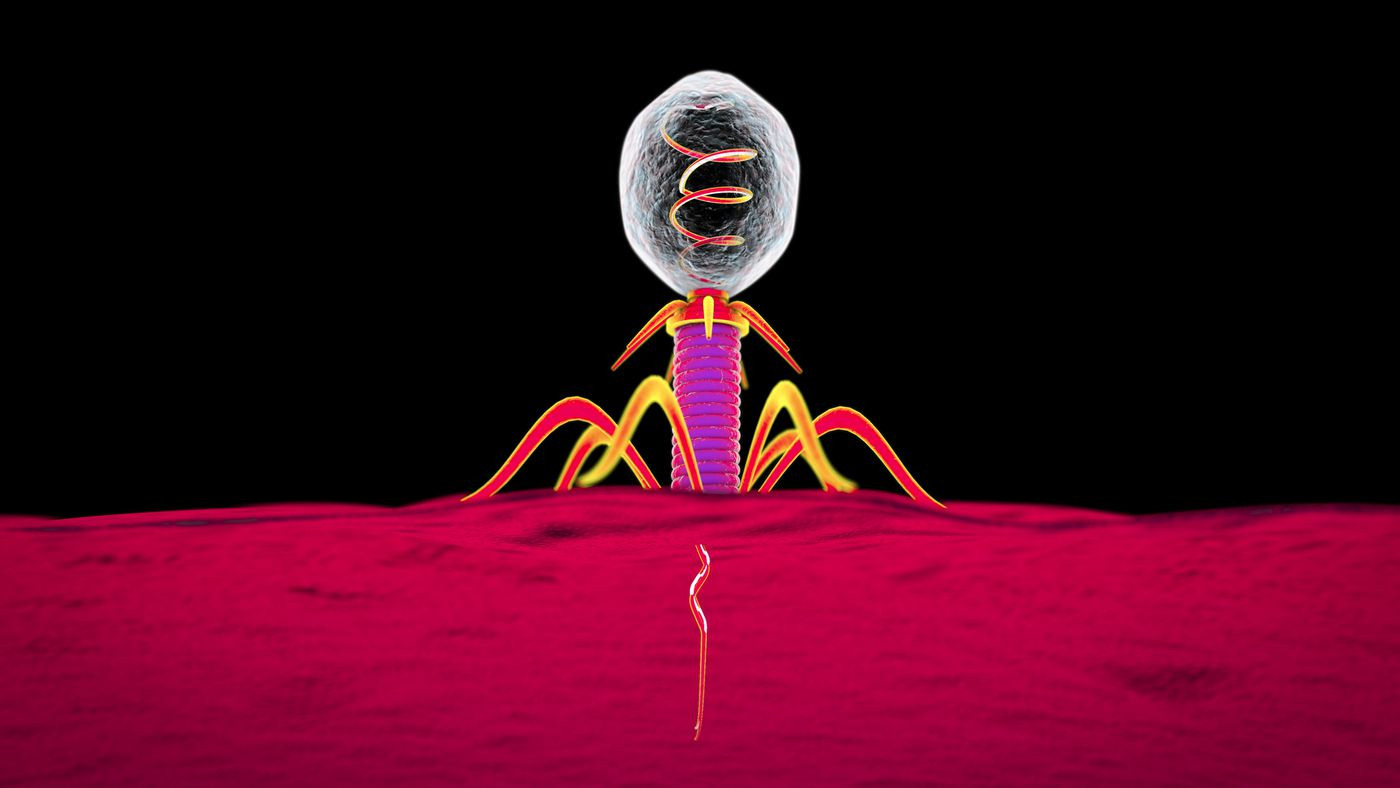
Фаги заняты любимым делом — атакуют бактерию.
После Второй мировой войны сложилась парадоксальная ситуация. В США и Западной Европе бактериофаги оставались в фокусе внимания только у биологов, а в странах Восточного блока из бактериофагов создавали реальные лекарства. В результате Россия стала мировым лидером по количеству зарегистрированных бактериофаговых препаратов.
В США ренессанс бактериофагов случился только в последние годы. В мае 2019 г. были опубликованы результаты применения смеси трех типов бактериофагов на пациенте с трудноизлечимой инфекцией, вызванной одним из представителей нетуберкулезных микобактерий Mycobacterium abscessus. Результаты обнадеживают — пациент пошел на поправку.
Уже начались исследования ряда других природных и генетически модифицированных штаммов бактериофагов, но доступные массовому потребителю препараты, эффективные против некоторых бактерий, появятся только через несколько лет.
Несмотря на достижения, мы стоим в самом начале долгой и изнурительной борьбы с бактериями — главная битва впереди. Пока же большинство фагов не описаны либо недоступны для генетических манипуляций.
Другие инструменты решения антибактериальной проблемы также далеко несовершенны. Тем временем без наращивания темпов химико-фармацевтических исследований нас ждут непростые десятилетия глобальных угроз.
В сентябре 2019 г. Глобальный комитет по мониторингу готовности (GPMB) представил отчет «Мир под угрозой», в котором признал реальной вероятность появления патогена, способного уничтожить в новой пандемии 50—80 млн человек.
