
Мир, окружающий нас, велик и таинственен. Многие его секреты были нами разгаданы, многие еще предстоит разгадать. С точки зрения познания часто говорят о том, что мы крайне мало знаем о Вселенной, в которой живем. Однако наши знания еще ничтожнее, чем кажется на первый взгляд, ибо об океанах нашей родной планеты нам известно далеко не все. Даже тело человека и процессы, протекающие в нем, оставляют немало неотвеченных вопросов. Во многом можно сказать, что мы видим картину, понимаем ее смысл, но детали нам пока не ясны. Особенно, если речь идет об эмбриональном развитии человека. Этот процесс изучать крайне сложно, как и с точки зрения научных знаний и методологии, так и с точки зрения морально-этических норм и правил. Посему группа ученых из Калифорнийского технологического института (США) разработала методику, позволяющую создавать эмбрионоподобные структуры из стволовых клеток человека. Как именно работает методика, насколько созданные «эмбрионы» идентичны оригиналам, и какие данные можно получить из создаваемых структур? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Нельзя отрицать тот факт, что процесс зарождения новой жизни, в том числе и человеческого дитя, является настоящим чудом. Это может и не быть то чудо, о котором пишут в древних писаниях или мифах, легендах и сказках, но это на самом деле чудо природы. Две клетки, размеры которых ничтожно малы, сливаются воедино и начинают сложный, долгий и полный метаморфоз процесс формирования будущего человечка. Речь, конечно же, о сперматозоиде и яйцеклетке. Длина первого составляет примерно 55 мкм, а диаметр второй — около 130 мкм.
Объединившись, сперматозоид и яйцеклетка формируют зиготу — тотипотентную клетку, которая в дальнейшем подвергается непрерывному делению без увеличения размера, в результате чего через четыре дня после оплодотворения образуется сфера, известная как морула. Дальнейшее деление и дифференцировка клеток приводит к образованию на пятый (шестой) день развития полой структуры — бластоциста (1A).

Изображение №1
На стадии бластоцисты определяются две основные группы клеток: внутренняя клеточная масса (ICM от inner cell mass), которая формирует собственно эмбрион, и первую внеэмбриональную ткань — трофэктодерму (TE от trophectoderm), т.е. эпителий, который дает начало клеткам плаценты.
Непосредственно перед имплантацией эмбриона на шестой день внутренняя клеточная масса начинает дифференцироваться на эпибласт (EPI от epiblast) и гипобласт (HYPO от hypoblast), что дает начало всем эмбриональным клеткам и внэмбриональному желточному мешку соответственно.
После имплантации EPI претерпевает серию морфологических изменений, ведущих к образованию трехмерной (3D) розетки, которая затем образует уплощенную дискообразную структуру, которая инициирует гаструляцию на четырнадцатый день.
Ученые крайне прагматично заявляют, что одним из факторов, затрудняющих изучение эмбрионов, является факт того, что они развиваются внутри матери. Тем не менее существуют методы, позволяющие проводить изучение эмбрионов вне матки, но для этого используются избыточные эмбрионы, полученные в результате искусственного оплодотворения. Такая методика сопряжена не только со сложностями научного характера, но и морально-этическими сложностями, возникающими в результате исследований подобного характера. По этой причине знаний, касательно раннего этапа эмбрионального развития на стадии бластоцисты, крайне мало.
Именно посему любые попытки воссоздать эмбриональную структуру без применения фактического эмбриона считаются крайне важными. Существует теория, что плюрипотентные стволовые клетки человека (hPSC от human pluripotent stem cell) при определенных условиях могут подвергаться самоорганизации в трехмерные структуры, подобные эмбрионам. Именно это и решили проверить авторы рассматриваемого нами сегодня исследования.
Недавние исследования показали, что PSC могут быть перепрограммированы в молекулярное состояние, называемое расширенным или расширенной плюрипотентностью (EP от expanded pluripotency), что имеет потенциал развития как для эмбриональных, так и для экстраэмбриональных клеточных линий. Учитывая это, возникает вопрос — могут ли hPSC, выращиваемые в условиях EP (называемые в таком случае hEPSC) и культивируемые с комбинацией подходящих факторов роста и/или ингибиторов, улавливать аспекты раннего эмбрионального развития в 3D-культуре.
Результаты исследования
В первую очередь было проведено преобразование hPSC в hEPSC как минимум за 5 пассажей*.
Пассирование клеток* — операция, осуществляемая с клетками и клеточными линиями при посеве их на субстрат для дальнейшей культивации. Каждая такая операция пассирования называется пассаж.Полученные клетки приобрели некоторые морфологические особенности, характерные для плюрипотентных клеток в наивном состоянии плюрипотентности, включая образование колоний куполообразных клеток (1B). В то же время можно наблюдать наличие колонии плоских клеток, характерный для плюрипотентных клеток в примированном состоянии. Такие клетки присутствовали в различных соотношениях после каждого пассажа. Из этого следует, что имеет место смешанная популяция клеток в разных плюрипотентных состояниях в условиях EP культивирования.
С помощью мульти-инвертированной пирамидальной системы 3D-культивирования на основе микролунок был сделан посев большого количество hEPSC (5-6 клеток на микролунку), чтобы обеспечить возможность их агрегации и последующей самоорганизации (1С).
Ученые отмечают, что использование классических культуральных сред для эмбрионов способствует образованию кавитированных кистозных структур. Чтобы сохранить уровень плюрипотентности и способствовать TE-подобной дифференцировке, ученые смешали 2 части такой среды с 1 частью EP25 и 1 частью hTSC29 (эти две среды используются для стволовых клеток). Также было замечено, что условия низкого давления кислорода (5% O2) способствует образованию кавитированных структур.
Далее была выполнена проверка различных факторов роста (в данном случае их роль играли цитокины — небольшие пептидные информационные молекулы). Было установлено, что комбинация BMP4 (20 нг/мл), агониста WNT CHIR99021 (2 мкМ), FGF2 (40 нг/мл) и ингибитора ROCK Y-27632 (5 мкМ) в течение первых 48 часов культивирования повышала выживаемость клеток и способствовала формированию компактных клеточных агрегатов. Временно был использован ингибитор киназы ALK5 A83-01 (2 мкМ), способствующий дифференцировке ТЕ29, но спустя 48 часов культивирования ингибитор был удален, чтобы избежать полной потери плюрипотентности. По этой же причине концентрация FGF2 была уменьшена вдвое до 20 нг/мл.
Подобная схема культивирования позволила наблюдать успешное формирование кавитированных структур уже через 3-4 дня после посева клеток (1D). На шестой день начала проявляться специфическая морфология, подобная той, что присуствует в бластоцистах. Образовывался единый внешний слой с увеличенной плотностью и внутренним ацентрическим отделением (1E). Иммунофлуоресцентный анализ выбранных маркеров (1F-1H) показал, что 7.2% клеток экспрессировали маркеры трех бластоцистных линий. Среднее количество клеток и диаметр этих hEP-структур были сопоставимы с таковыми у человеческих бластоцистах (1I и 1J).
Важно отметить, что первое событие сегрегации клеточных клонов (группы клеток, происходящих из одной клетки) начинается с уплотнения и поляризации клеток в эмбрионе мыши на 8-клеточной стадии*.
Стадия восьми клеток* (8-клеточная стадия) — стадия эмбрионального развития, когда концептус претерпел три деления от одной клетки, в результате чего образовалось 8 клеток.
Следовательно, авторы труда использовали созданную ими платформу для анализа формирования и динамики клеточной поляризации на ранних этапах формирования многоклеточных агрегатов.
В результате наблюдалась сборка межклеточных соединений, характеризующаяся базолатеральной локализацией E-кадгеринов* (2A).
Кадгерины* — основной класс молекул клеточной адгезии, обеспечивающие кальций-зависимое гомофильное соединение клеток в плотных тканях организма.

Изображение №2
В течение первых 48 часов агрегации клеток на апикальной (расположенной на верхушке) поверхности было обнаружено отчетливое увеличение F-ACTIN и PARD6 (2A), что указывает на поляризацию клеток в hEP-структурах.
Далее был проведен анализ пространственно-временной экспрессии фактора транскрипции GATA3 как маркера спецификации TE в эмбриогенезе человека. GATA3 присутствовал в ядре как в поляризованных, так и в неполяризованных клетках на 2-й и 3-й день культивирования, хотя его интенсивность была значительно выше в поляризованных клетках, показывающих апикальное обогащение PARD6 (2A и 2B). Эти наблюдения сильно коррелируют с наблюдениями за естественными человеческими эмбрионами на стадии морулы (2C).
Ученые отмечают, что путь PLC-Protein Kinase C (PKC) контролирует клеточную поляризацию на ранних стадиях развития эмбриона мыши. Поэтому hEPSC культуры были обработаны 2 мкМ и 3 мкМ ингибитора PLC (U73122). Ингибирование PLC привело к снижению интенсивности ядерного сигнала GATA3 (2D и 2E), что коррелировало с уменьшением апикального обогащения PARD6.
Чтобы подтвердить взаимосвязь между поляризацией и внешней фиксацией клеток, использовалась трансфекция* siRNA для нокдауна PLCB1, дабы истощить активность PLC в клетках во время агрегации (2F).
Трансфекция* — процесс введения нуклеиновой кислоты в клетки эукариот невирусным методом.На третий день было обнаружено значительно снижение экспрессии как PARD6, так и GATA3 в агрегатах hEPSC.

Изображение №3
На следующем этапе исследования проводился анализ формирования клонов бластоцисты при кавитации (образование полостей) hEP-структур, начиная с четвертого дня. Полимеразная цепная реакция в реальном времени (qRT-PCR) была использована для определения уровня экспрессии основных факторов, участвующих в установлении идентичности бластоцистоподобных клонов человека (3A). Данный анализ показал, что гены, участвующие в спецификации TE (т.е. PLAC8, CDX2, KRT8 и KRT18), индуцировались при образовании кистозных структур, хотя GATA3 показал лишь незначительное увеличение по сравнению с другими молекулярными детерминантами идентичности TE (3A).
Ключевые факторы транскрипции, необходимые для спецификации плюрипотентного EPI (т.е. NANOG и POU5F1) показывали сходные уровни экспрессии в кистозных структурах. Также было установлено, что экспрессия основных генов детерминант линии HYPO, PDGFRA и GATA6, была сильно обогащена кистозными структурами, в отличие от SOX17.
Дабы подтвердить эти результаты, был проведен иммунофлуоресцентный анализ, который также показал обогащение KRT18 снаружи и экспрессию маркеров OCT4/SOX17 во внутреннем компартменте (3B). Далее наблюдалась спецификация внутреннего компартмента с помощью второго набора маркеров (SOX2/FOXA236; 3C).
На четвертый день в некоторых структурах обнаруживалась конститутивная экспрессия GATA3 во внешнем слое клеток при сохранении экспрессии hPSC/EPI маркера OCT4 (3D). Уже на шестой день некоторые структуры продолжали проявлять экспрессию GATA3 во внешнем слое, хотя это обогащение стало в основном цитозольным, а не ядерным (3E).
Существует теория, что добавка WNT3A способствует кавитации и, следовательно, идентичности TE-подобной линии в образовании бластоидов мыши. Однако добавление WNT3A к культуральной среде не оказало существенного влияния на выход кавитированных структур на шестой день (3F).
Далее необходимо было проверить, насколько hEP-структуры хорошо могут развиваться после стадии имплантации (4A). Это было сделано путем их культивирования на специально подготовленной культуре эмбрионов человека in vitro (IVC от in vitro culture, т.е. на стекле).
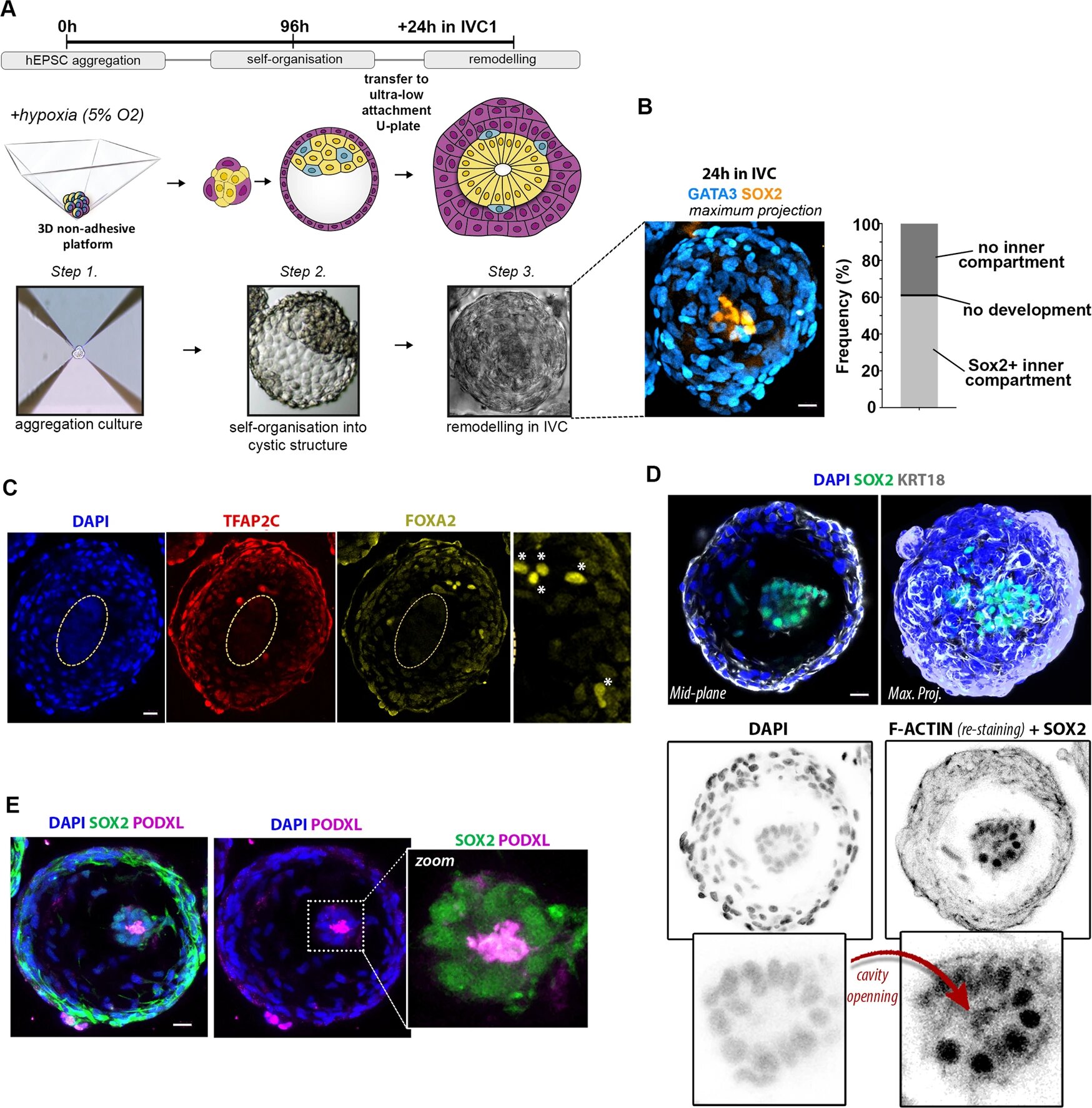
Изображение №4
В течение 24 часов в IVC EP-структуры реорганизовались в морфологию, подобную постимплантационной (4B-4D). Также были замечены структуры с клетками, экспрессирующими FOXA2, предполагая HYPO-подобную спецификацию (4C). Образование небольшой полости было подтверждено экспрессией PODXL (4E).
Вышеописанные результаты говорят о том, что исследуемые hEP-структуры способны осуществлять некоторые клеточные перестройки, характерные для раннего морфогенеза человека.
Дополнительно было проведено секвенирование ДНК одиночных клеток hEPSC, выращенных в двумерной культуре (т.е. перед трехмерной агрегацией), hEP-структур на пятый день, выраженных в IVC, и бластоцист человека (5/6 день развития).

Изображение №5
Все клетки группировались на основе идентичности к образцу (5A и 5B). Клоны относились к определенной категории, если демонстрировали четко определенные маркеры и сигнатуры EPI-подобных клеток (ELC), TE-подобных клеток (TLC) и HYPO-подобных клеток (HLC).
Данный анализ показал, что hEP-структуры содержат большое число неопределенных клеток (5C). Кроме того, также было обнаружено, что в естественной бластоцисте преобладали HLC по сравнению с клетками HYPO (5B и 5C). В hEP-структурах (пятый день развития) была выявлена небольшая субпопуляция GATA3-подобных клеток, которые сгруппировались близко к TE кластеру естественного эмбриона (5D).
Несмотря на то, что наблюдалась значительная экспрессия маркеров в ELC, HLC и TLC (5E), наблюдалось и непропорциональное число клонов в hEP-структурах. Это видно по большому числу HYPO-специфических и относительно малому числу ТЕ-специфических маркеров.
Сравнение схем экспрессии ключевых маркерных генов, используемых для определения сигнатур ELC, HLC и TLC в hEP-структуре и в естественных бластоцистах человека показало, что более половины генов не различаются между ELC и EPI человека.
Итогом всех этих наблюдений является факт того, что хоть в hEP-структурах и происходит на каком-то этапе транскрипционный процесс, однако полная транс-дифференцировка клеток не достигается.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые создали из стволовых клеток структуры, подобные эмбрионам. В действительности эмбрион формируется путем слияния сперматозоида и яйцеклетки. Но вот разработанная структура образуется путем комбинирования плюрипотентных стволовых клеток, которые способны развиваться в определенный тип клетки.
Ученые честно заявляют, что между реальным эмбрионом и разработанной ими структурой существует ряд существенных отличий. Однако стволовые клетки все же способны формировать структуры, морфология которых сильно напоминает эмбриональную на ранних этапах развития. Это можно назвать клеточной памятью, т.е. клетки, взятые из реального эмбриона для данного исследования, изначально имеют предрасположенность собираться в эмбрион, если условия среды подходящие. Проблема в том, что на определенном этапе процесс начинает замедляться, и структура перестает дальнейшее формирование. Возможно, как считают ученые, необходимо разработать метод, позволяющий усилить внутреннюю память клетки, чтобы этот процесс был завершен успешно.
В будущем предстоит еще много работы, чтобы можно было в лабораторных условиях создавать полноценные искусственные эмбрионоподобные структуры. Однако перспектива такой технологии крайне заманчива, так как для изучения развития человека более не придется полагаться на донорские эмбрионы. Имея избыток модельных структур эмбриона, ученые смогут не только лучше понять, как мы развиваемся в утробе матери, но и создать методики более точного выявления патологий даже на генетическом уровне. В результате мы получим инструменты для борьбы с заболеваниями, которые считались неизлечимыми или недиагностируемыми, пока не становится поздно.
Любые исследования, которые так или иначе связаны (или хотя бы упоминают) с эмбрионами, всегда вызывали много вопросов со стороны общественности. Однако стоит понимать, что мы не способны понять, как именно работает та или иная система, если не будем иметь возможности рассмотреть ее детально. Посему подобного рода разработки могут стать идеальным компромиссом по крайней мере на какое-то время.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
