Предыдущая публикация получила отрицательную оценку с формулировкой «зачем здесь размещать столь элементарные вещи». Поэтому я сразу предупреждаю, что данный материал предназначен, в первую очередь, для школьников, начинающих изучать химию. А также для тех, кому этот предмет был непонятен в школьные годы. Я бы поместил статью на популярном специализированном ресурсе для школьников, если бы он существовал.
И да, я в курсе существования модели атома, в которой электрон представляет собой волну вероятности, расположенную вблизи ядра. Но школьнику, как правило, трудно представить себе то, как вероятность может соединять атомы в молекулы. Поэтому излагаю «на пальцах».
Соединение атомов в молекулы
Наш мир не существует в виде отдельных атомов, они каким-то образом соединяются друг с другом. Каким именно?
Возьмем два атома водорода. Каждый из них содержит по одному протону и по одному электрону, поэтому суммарный заряд каждого из этих атомов равен нулю.
Закон Кулона
F = k*q1*q2/r^2
говорит нам, что нейтральные тела не должны притягиваться друг к другу
(q1 = 0, q2 = 0).
А значит, водород (и любой другой химический элемент) должен существовать только в виде атомов, и никогда не соединяться в молекулы. На самом же деле атомы водорода всегда соединяются попарно. Почему?
Давайте возьмем два отрезка металла, и расположим их параллельно на небольшом расстоянии друг от друга.
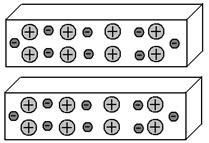
Оба отрезка содержат одинаковое количество протонов и электронов, следовательно, суммарный заряд каждого из них равен нулю. А значит, они не имеют причин для взаимного притяжения.
Мы знаем, что в металлах часть внешних электронов покидает свои атомы и свободно гуляет между ионами (покинутыми атомами) кристаллической решетки металла. И распределены эти электроны, в среднем, равномерно.
Представьте себе, что нам удалось каким-то образом переместить часть этих свободных электронов в левую часть нижнего отрезка металла. При этом в его правой части окажется дефицит электронов.
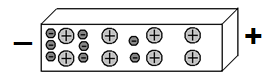
Мы получили так называемый диполь: левая часть отрезка заряжена отрицательно, правая – положительно. Отлично. А что будет происходить в верхнем отрезке? Мы знаем, что одноименные заряды отталкиваются друг от друга, а противоположные — притягиваются. Следовательно, электроны верхнего отрезка, отталкиваясь от электрических полей электронов нижнего отрезка, уйдут в правую часть. То есть, картина распределения электронов в этих двух отрезках металлов станет зеркальной:
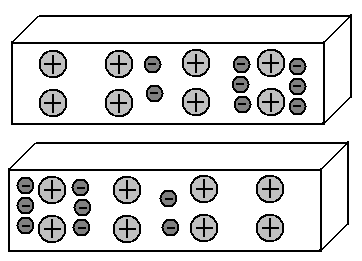
Такое влияние заряженных предметов на соседние предметы, приводящее к перераспределению зарядов в них, называется электростатической индукцией.
Теперь самое интересное: положительно заряженные ядра атомов в левой части верхнего отрезка оказались напротив электронов, собранных в левой части нижнего отрезка. А противоположные заряды притягиваются. Значит, левые части отрезков начнут притягиваться друг к другу!
То же самое будет происходить в правой части отрезков – только зеркально. И правые концы отрезков также будут притягиваться друг к другу. Чудесно, не так ли? Перераспределение зарядов внутри одного из отрезков проводников, привело к взаимному притяжению этих двух отрезков!
А что произойдет, если теперь переместить свободные электроны нижнего отрезка в его правый конец? Тогда свободные электроны верхнего отрезка переместятся в левый конец. То есть, перемещая электроны туда – сюда в одном из отрезков, мы заставляем перемещаться электроны соседнего отрезка, никак не связанного с первым! Такое влияние перемещения электронов в одном проводнике на перемещение электронов в соседнем проводнике называется электродинамической индукцией.
Хотя это и не относится к нашей теме, отметим, что мы с вами в несколько упрощенном виде изучили, как работает антенна и приемник при радиопередаче.
Мы можем расположить эти два отрезка металла иначе – торцами друг к другу:
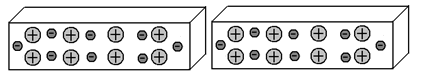
Если мы сумеем переместить электроны, допустим, в правую часть левого отрезка, электроны правого отрезка, отталкиваясь от них, также переместятся в правую часть правого отрезка:
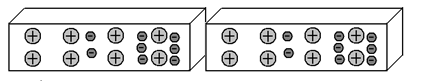
И в этом случае эти два отрезка металла начнут притягиваться друг к другу, так как их ближние концы имеют противоположный заряд. Следует особо обратить внимание на то, что во втором варианте расположения отрезков, сила их взаимного притяжения будет слабее, так как притягиваются только их встречные торцы, в то время, как при первом варианте расположения отрезков, притягивались друг к другу как левые, так и правые концы.
Но как это относится к соединению атомов? Давайте посмотрим на атом водорода. В нем имеется электрон, перемещающийся вокруг ядра. И если рядом окажется второй атом водорода, этот электрон заставит электрон соседа перемещаться примерно так же, как они перемещались в наших отрезках металла – пока электрон одного из атомов находится с одной стороны ядра своего атома, соседний будет вынужден находиться с противоположной стороны своего атома.
Здесь, разумеется, влияние не одностороннее, а взаимное – как первый электрон влияет на второй, так и второй влияет на первый. Но самое главное в том, что эти два атома будут притягиваться точно так же, как притягивались два куска металла во втором варианте их взаимного размещения (торцами друг к другу).
Суть такая же: электроны держатся подальше друг от друга, позволяя разноименным зарядам притягиваться друг к другу. Представьте себе, что электрон одного из атомов оказался между ядрами двух соседних атомов, в то время, когда электрон соседнего атома находился в противоположной, удаленной точке орбиты:
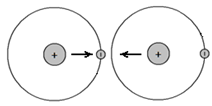
Теперь у нас есть отрицательно заряженный электрон, находящийся между двумя положительно заряженными ядрами атомов. Ядра обоих атомов притягиваются к этому электрону. Таким образом, электрон в данный момент связывает два атома.
Расстояние между ядрами атомов больше, чем расстояние от каждого из ядер до электрона, находящегося между ними. А мы помним, что сила взаимодействия зарядов обратно пропорциональна квадрату расстояния между ними. Поэтому, в данный момент, сила притяжения ядер к электрону больше, чем взаимное отталкивание ядер.
Но электроны постоянно перемещаются, и поэтому через некоторое время первый электрон покидает место между ядрами, зато туда перемещается второй электрон. В этот момент роль связующего переходит электрону второго атома (момент 3 на рисунке ниже).
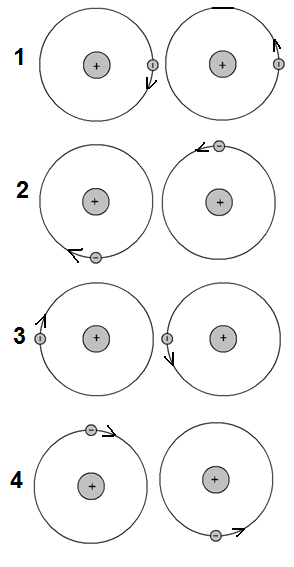
Заметим, что в моменты времени, показанные на рисунках 2 и 4, между ядрами атомов нет электронов. В эти моменты ядра отталкиваются друг от друга. По этой причине расстояние между атомами колеблется — постоянно меняется в процессе вращения электронов вокруг ядер, но сохраняется ее средняя длина, называемая длиной связи. Длина связи – расстояние между ядрами атомов — индивидуальна для каждой пары видов атомов, объединенных в молекулу.
Электроны этих двух атомов в образовавшейся молекуле водорода стараются находиться как можно дальше друг от друга так же, как они делали это в отрезках металлов. За счет этого происходит их синхронизация – их расположение относительно друг друга на каждом обороте вокруг ядер примерно одинаково.
Это несколько напоминает коллективное исполнение вальса, когда пары вращаются с одинаковой скоростью таким образом, чтобы ни дамы, ни кавалеры никогда не оказывались рядом друг с другом, а всегда чередовались:

Данная статья — выдержка из книги «Понятная химия».
Святая Неопределенность и Святая Вероятность
Квантовая теория утверждает, что невозможно одновременно определить точное место электрона в пространстве и его импульс (направление и скорость его движения). Поэтому считается, что вокруг ядра атома существуют некие места (области), в которых вероятность обнаружить электрон высока. Эти области и называют орбиталями электронов.
Эту теорию нетрудно объяснить на бытовом примере. Допустим, вы живете в квартире, в которой есть спальня кухня и санузел. Если вы 90% времени проводите в спальне, 8% времени – на кухне, и 2% времени в санузле, то вашей орбиталью можно считать спальню и кухню, так как вероятность обнаружить вас в санузле очень низкая. Проведя 100 наблюдений за вами в разные моменты времени, наблюдатель, скорее всего, обнаружит вас в 90 случаях в спальне, и в 8 случаях – на кухне. И по этим цифрам придет к выводу об ареале вашего обитания.
Теперь о том, почему невозможно одновременно определить место электрона в пространстве и его скорость, и направление движения. Тут еще проще. Дело в том, что скорость можно измерить только на некотором отрезке пройденного пути. Разделив длину этого отрезка на время, за которое он пройден, мы можем узнать скорость движения. Но ведь мы не можем считать местом расположения тела отрезок пространства. Место – это точная координата тела.
Представьте себе, что в темной комнате летает муха. Осветив комнату очень короткой вспышкой света, мы можем увидеть место, в котором муха находится в данный момент. Но чтобы понять то, куда и с какой скоростью она летит, нам придется включить свет на более длительное время. Тогда мы увидим изменение положения мухи с течением времени и сможем оценить скорость этого изменения. Но в этом случае мы уже не можем указать точное место, в котором муха находилась во время измерения ее скорости, так как за это время она переместилась на некоторое расстояние. Вот и весь смысл принципа неопределенности.
Электроны, перемещающиеся вокруг ядер атомов, очень быстро меняют скорость и направление движения, поэтому невозможно сказать точно, где они находятся в данный момент времени и куда движутся.
А в модели, рассмотренной выше, электроны движутся, как стрелки в часах. И это не может не вызвать праведного гнева адептов Святой Неопределенности и Святой Вероятности.
Однако то, что мы не можем точно сказать, где именно находится тот или иной электрон, и какому из атомов он «принадлежит» нисколько не меняет электростатического механизма связывания атомов. Невозможно связать два протона иначе, как разместив между ними электрон. Никакая вероятность или неопределенность не может соединить атомы в молекулу. И это отлично демонстрирует молекулярный ион водорода H2+. В этом ионе нет ни дублета электронов, ни компенсации спинов спаренных электронов, ни перекрытия электронных облаков, тем не менее, данный ион существует и он устойчив.
К тому же, не стоит забывать то, что это всего лишь модель, и ее «объяснительные» возможности ограничены, как и возможности любых других моделей. Например, она (вроде бы) не объясняет, почему атомы водорода не могут соединяться в длинные цепи типа H3, H4 и т.д.
Впрочем, можно предположить, что из-за того, что электронные орбитали в молекулах водорода смещены к центру молекулы, они не «высовываются» из ее концов, и поэтому соседние молекулы водорода не имеют возможности прицепиться друг к другу, используя механизм синхронизации электронов.
И да, я в курсе существования модели атома, в которой электрон представляет собой волну вероятности, расположенную вблизи ядра. Но школьнику, как правило, трудно представить себе то, как вероятность может соединять атомы в молекулы. Поэтому излагаю «на пальцах».
Соединение атомов в молекулы
Наш мир не существует в виде отдельных атомов, они каким-то образом соединяются друг с другом. Каким именно?
Возьмем два атома водорода. Каждый из них содержит по одному протону и по одному электрону, поэтому суммарный заряд каждого из этих атомов равен нулю.
Закон Кулона
F = k*q1*q2/r^2
говорит нам, что нейтральные тела не должны притягиваться друг к другу
(q1 = 0, q2 = 0).
А значит, водород (и любой другой химический элемент) должен существовать только в виде атомов, и никогда не соединяться в молекулы. На самом же деле атомы водорода всегда соединяются попарно. Почему?
Давайте возьмем два отрезка металла, и расположим их параллельно на небольшом расстоянии друг от друга.

Оба отрезка содержат одинаковое количество протонов и электронов, следовательно, суммарный заряд каждого из них равен нулю. А значит, они не имеют причин для взаимного притяжения.
Мы знаем, что в металлах часть внешних электронов покидает свои атомы и свободно гуляет между ионами (покинутыми атомами) кристаллической решетки металла. И распределены эти электроны, в среднем, равномерно.
Представьте себе, что нам удалось каким-то образом переместить часть этих свободных электронов в левую часть нижнего отрезка металла. При этом в его правой части окажется дефицит электронов.

Мы получили так называемый диполь: левая часть отрезка заряжена отрицательно, правая – положительно. Отлично. А что будет происходить в верхнем отрезке? Мы знаем, что одноименные заряды отталкиваются друг от друга, а противоположные — притягиваются. Следовательно, электроны верхнего отрезка, отталкиваясь от электрических полей электронов нижнего отрезка, уйдут в правую часть. То есть, картина распределения электронов в этих двух отрезках металлов станет зеркальной:
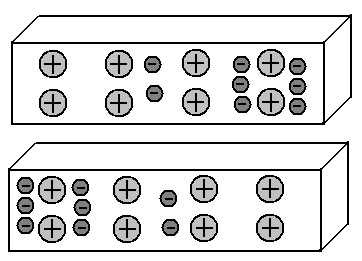
Такое влияние заряженных предметов на соседние предметы, приводящее к перераспределению зарядов в них, называется электростатической индукцией.
Теперь самое интересное: положительно заряженные ядра атомов в левой части верхнего отрезка оказались напротив электронов, собранных в левой части нижнего отрезка. А противоположные заряды притягиваются. Значит, левые части отрезков начнут притягиваться друг к другу!
То же самое будет происходить в правой части отрезков – только зеркально. И правые концы отрезков также будут притягиваться друг к другу. Чудесно, не так ли? Перераспределение зарядов внутри одного из отрезков проводников, привело к взаимному притяжению этих двух отрезков!
А что произойдет, если теперь переместить свободные электроны нижнего отрезка в его правый конец? Тогда свободные электроны верхнего отрезка переместятся в левый конец. То есть, перемещая электроны туда – сюда в одном из отрезков, мы заставляем перемещаться электроны соседнего отрезка, никак не связанного с первым! Такое влияние перемещения электронов в одном проводнике на перемещение электронов в соседнем проводнике называется электродинамической индукцией.
Хотя это и не относится к нашей теме, отметим, что мы с вами в несколько упрощенном виде изучили, как работает антенна и приемник при радиопередаче.
Мы можем расположить эти два отрезка металла иначе – торцами друг к другу:

Если мы сумеем переместить электроны, допустим, в правую часть левого отрезка, электроны правого отрезка, отталкиваясь от них, также переместятся в правую часть правого отрезка:

И в этом случае эти два отрезка металла начнут притягиваться друг к другу, так как их ближние концы имеют противоположный заряд. Следует особо обратить внимание на то, что во втором варианте расположения отрезков, сила их взаимного притяжения будет слабее, так как притягиваются только их встречные торцы, в то время, как при первом варианте расположения отрезков, притягивались друг к другу как левые, так и правые концы.
Но как это относится к соединению атомов? Давайте посмотрим на атом водорода. В нем имеется электрон, перемещающийся вокруг ядра. И если рядом окажется второй атом водорода, этот электрон заставит электрон соседа перемещаться примерно так же, как они перемещались в наших отрезках металла – пока электрон одного из атомов находится с одной стороны ядра своего атома, соседний будет вынужден находиться с противоположной стороны своего атома.
Здесь, разумеется, влияние не одностороннее, а взаимное – как первый электрон влияет на второй, так и второй влияет на первый. Но самое главное в том, что эти два атома будут притягиваться точно так же, как притягивались два куска металла во втором варианте их взаимного размещения (торцами друг к другу).
Суть такая же: электроны держатся подальше друг от друга, позволяя разноименным зарядам притягиваться друг к другу. Представьте себе, что электрон одного из атомов оказался между ядрами двух соседних атомов, в то время, когда электрон соседнего атома находился в противоположной, удаленной точке орбиты:

Теперь у нас есть отрицательно заряженный электрон, находящийся между двумя положительно заряженными ядрами атомов. Ядра обоих атомов притягиваются к этому электрону. Таким образом, электрон в данный момент связывает два атома.
Расстояние между ядрами атомов больше, чем расстояние от каждого из ядер до электрона, находящегося между ними. А мы помним, что сила взаимодействия зарядов обратно пропорциональна квадрату расстояния между ними. Поэтому, в данный момент, сила притяжения ядер к электрону больше, чем взаимное отталкивание ядер.
Но электроны постоянно перемещаются, и поэтому через некоторое время первый электрон покидает место между ядрами, зато туда перемещается второй электрон. В этот момент роль связующего переходит электрону второго атома (момент 3 на рисунке ниже).

Заметим, что в моменты времени, показанные на рисунках 2 и 4, между ядрами атомов нет электронов. В эти моменты ядра отталкиваются друг от друга. По этой причине расстояние между атомами колеблется — постоянно меняется в процессе вращения электронов вокруг ядер, но сохраняется ее средняя длина, называемая длиной связи. Длина связи – расстояние между ядрами атомов — индивидуальна для каждой пары видов атомов, объединенных в молекулу.
Электроны этих двух атомов в образовавшейся молекуле водорода стараются находиться как можно дальше друг от друга так же, как они делали это в отрезках металлов. За счет этого происходит их синхронизация – их расположение относительно друг друга на каждом обороте вокруг ядер примерно одинаково.
Это несколько напоминает коллективное исполнение вальса, когда пары вращаются с одинаковой скоростью таким образом, чтобы ни дамы, ни кавалеры никогда не оказывались рядом друг с другом, а всегда чередовались:

Данная статья — выдержка из книги «Понятная химия».
Святая Неопределенность и Святая Вероятность
Квантовая теория утверждает, что невозможно одновременно определить точное место электрона в пространстве и его импульс (направление и скорость его движения). Поэтому считается, что вокруг ядра атома существуют некие места (области), в которых вероятность обнаружить электрон высока. Эти области и называют орбиталями электронов.
Эту теорию нетрудно объяснить на бытовом примере. Допустим, вы живете в квартире, в которой есть спальня кухня и санузел. Если вы 90% времени проводите в спальне, 8% времени – на кухне, и 2% времени в санузле, то вашей орбиталью можно считать спальню и кухню, так как вероятность обнаружить вас в санузле очень низкая. Проведя 100 наблюдений за вами в разные моменты времени, наблюдатель, скорее всего, обнаружит вас в 90 случаях в спальне, и в 8 случаях – на кухне. И по этим цифрам придет к выводу об ареале вашего обитания.
Теперь о том, почему невозможно одновременно определить место электрона в пространстве и его скорость, и направление движения. Тут еще проще. Дело в том, что скорость можно измерить только на некотором отрезке пройденного пути. Разделив длину этого отрезка на время, за которое он пройден, мы можем узнать скорость движения. Но ведь мы не можем считать местом расположения тела отрезок пространства. Место – это точная координата тела.
Представьте себе, что в темной комнате летает муха. Осветив комнату очень короткой вспышкой света, мы можем увидеть место, в котором муха находится в данный момент. Но чтобы понять то, куда и с какой скоростью она летит, нам придется включить свет на более длительное время. Тогда мы увидим изменение положения мухи с течением времени и сможем оценить скорость этого изменения. Но в этом случае мы уже не можем указать точное место, в котором муха находилась во время измерения ее скорости, так как за это время она переместилась на некоторое расстояние. Вот и весь смысл принципа неопределенности.
Электроны, перемещающиеся вокруг ядер атомов, очень быстро меняют скорость и направление движения, поэтому невозможно сказать точно, где они находятся в данный момент времени и куда движутся.
А в модели, рассмотренной выше, электроны движутся, как стрелки в часах. И это не может не вызвать праведного гнева адептов Святой Неопределенности и Святой Вероятности.
Однако то, что мы не можем точно сказать, где именно находится тот или иной электрон, и какому из атомов он «принадлежит» нисколько не меняет электростатического механизма связывания атомов. Невозможно связать два протона иначе, как разместив между ними электрон. Никакая вероятность или неопределенность не может соединить атомы в молекулу. И это отлично демонстрирует молекулярный ион водорода H2+. В этом ионе нет ни дублета электронов, ни компенсации спинов спаренных электронов, ни перекрытия электронных облаков, тем не менее, данный ион существует и он устойчив.
К тому же, не стоит забывать то, что это всего лишь модель, и ее «объяснительные» возможности ограничены, как и возможности любых других моделей. Например, она (вроде бы) не объясняет, почему атомы водорода не могут соединяться в длинные цепи типа H3, H4 и т.д.
Впрочем, можно предположить, что из-за того, что электронные орбитали в молекулах водорода смещены к центру молекулы, они не «высовываются» из ее концов, и поэтому соседние молекулы водорода не имеют возможности прицепиться друг к другу, используя механизм синхронизации электронов.