Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).

На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
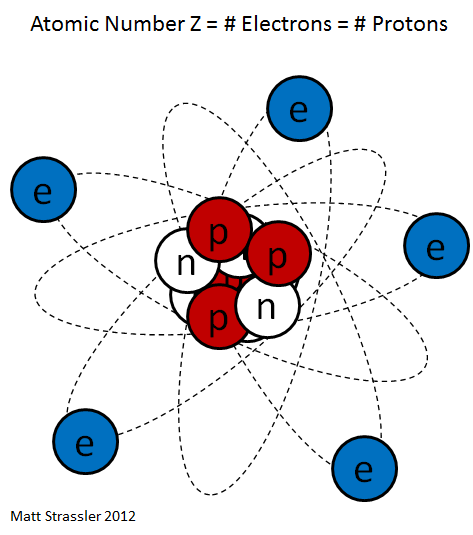
Рис. 1
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их з��ряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.
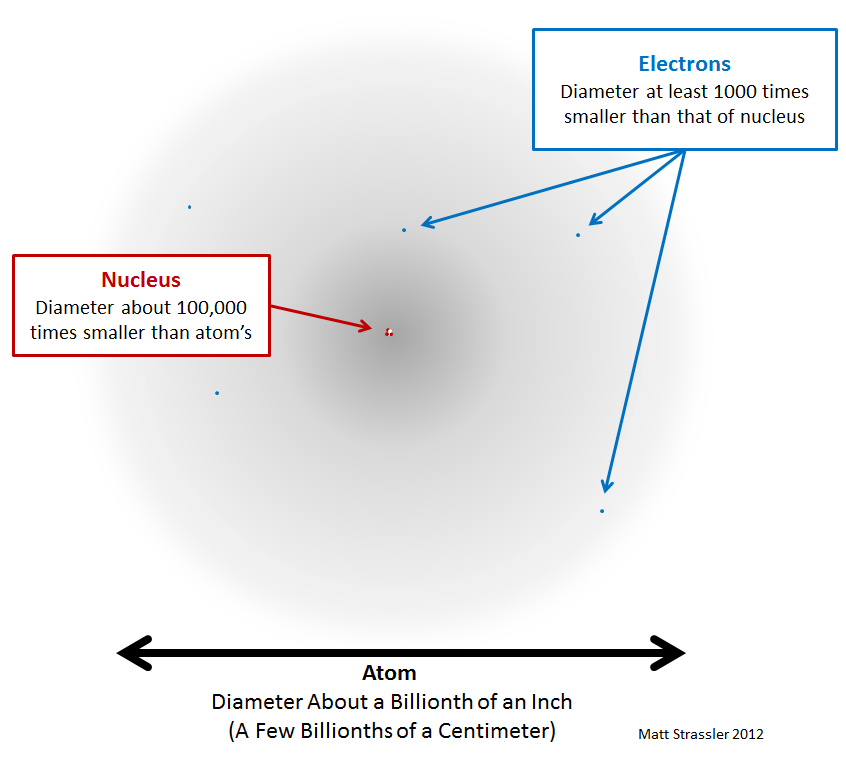
Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).

На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).

Рис. 1
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их з��ряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
