Привет, Хабр. Новый год в моём блоге начнётся со второго гостевого поста уважаемой Анастасии Новосадской @anastasiamrr — биолога и биоинформатика из Минска. Ранее Анастасия уже готовила для редакции Хабра пост о взломе и обфускации генетического кода на уровне ДНК, а также участвовала в подготовке материала об использовании нейросетей в современной биологии, опубликованного в блоге @SLY_G. На Хабре уже выходили посты о ДНК-оригами, как в авторских, так и в корпоративных блогах. Однако работа госпожи Новосадской даёт значительно более современный и не менее фундаментальный обзор проблемы, поэтому наверняка вас заинтересует. Далее — текст автора.
Привет, Хабр! Большинству из нас известно, что «оригами» — это японское искусство складывания фигурок из бумаги, а ДНК — это биомолекула, двойная спираль из нуклеотидов для переноса и реализации генетической информации. Интересно: что между ними общего, как могла возникнуть технология ДНК-оригами и для чего применяют? Постараемся разобраться.
Предпосылки для возникновения и прикладного использования ДНК-оригами
Живые существа (и, в том числе, человек разумный) отличаются сложной внутренней и внутриклеточной организацией. Эволюция сформировала множество систем, которые призваны защищать наш организм от вторжений. Многие из этих систем реализованы на молекулярном уровне, и именно на молекулярном уровне действуют механизмы атаки, применяемые многими патогенами. По мере накопления знаний о физиологии, молекулярной биологии, биохимии, медицине и других естественных науках человечество училось, методом проб и ошибок, подбирать такие способы и средства, которые бы повышали шансы на выздоровление, улучшение и продолжение жизни. Но ещё далеко не все такие механизмы изучены, а модели защиты и лечения не всегда показывают желаемый результат.
Одна из наиболее актуальных проблем фармакологии — прицельная доставка препаратов по организму, биодоступность. А в настоящее время это направление становится одним из важнейших в клинической фармакологии. Такую практику называют «таргетная» или «прецизионная» терапия. Препараты, предназначенные для избирательного воздействия и работы именно там, где это необходимо (во избежание токсического воздействия на окружающие ткани и клетки), называют «умными лекарствами».
В настоящее время на таргетную терапию возлагаются большие надежды. Однако с ней есть и проблемы. Весомым препятствием в доставке лекарств по организму к определённым органам и тканям являются биологические особенности тканей и клеток, а также работа иммунной системы и механизмы поддержания гомеостаза в организме. Например, если мы съедаем что-нибудь токсичное, яд не может проходить через ткани и задерживается в них, впоследствии сам претерпевает метаболические изменения внутри клеток: например окисление, восстановление, гидролиз, а также реакции конъюгации или реакции синтеза. К реакциям конъюгации можно отнести ацетилирование, метилирование и пр. Особенно активно это происходит в печени, где чужеродные для организма вещества подвергаются метаболической трансформации с последующим выведением через почки и кишечник. В случае с ядами это полезно и нужно. А вот с лекарствами – нет. Получается, что биологические системы защиты организма просто не позволяют лекарственным препаратам доходить до тех мест, где нужно провести терапию. Есть и ещё одна проблема. Наши клетки устроены таким образом, что они пускают в себя «нужные» им вещества и не впускают «ненужные». Многие лекарства, которые мы принимаем, могут проникать в клетки только в случае, если концентрация вещества очень высокая и система защиты просто не справляется. По сути, иногда приходится буквально перегружать печень и почки работой, чтобы они не успели уничтожить лекарство, пока оно будет работать. Более того, если же лекарство и попадает в клетку, которой требуется оказать терапевтическое действие, то сама эта клетка начнет сопротивляться и стремиться сохранить свой собственный гомеостаз. Клетка обрабатывает вещество ферментами, трансформирует его. В умеренно неприятном случае лекарство из-за этого становится бесполезным, а в худшем — токсичным. В настоящее время такие проблемы решаются разными способами, один из них — увеличение общей концентрации вводимого вещества, в надежде, что необходимое количество попадет «по адресу», не успев подвергнуться действию ферментов. На таком принципе основана классическая химиотерапия. Побочные эффекты такого подхода очевидны: если вещество вредное, то от него страдает весь организм, а не только орган-мишень. Несмотря на вышесказанное, увеличение концентрации вводимого вещества далеко не всегда прямо пропорционально улучшению состояния организма. Однако вред, как правило, при таком воздействии только увеличивается.
Другой способ — использование веществ, которые становятся лекарствами в процессе метаболической трансформации. Например, в крови человека возникает лекарство, которое не оказывает терапевтического действия. Оно попадает в клетку и метаболизируется ферментами этой клетки. В результате этой трансформации получается новое вещество, которое может оказывать терапевтический эффект именно в этой клетке. Преимущество такого подхода следующее — получившееся «лекарство» не будет расщеплено клетками печени, которые способны обезвреживать широкий спектр веществ. Недостаток такого решения — всё же невозможность создания лекарств для разных клеток и тканей для решения разных задач. По сути, создание подобных лекарств – обычно исключение, а не правило.
В настоящий момент взоры учёных устремлены на создание более универсальных препаратов. Представьте, что у человека болит только нога. Человеку приходится принимать лекарство, которое лечит не только ногу, а весь организм сразу. Чтобы достичь нужной концентрации лекарства в ноге, необходимо принять очень большое количество вещества. Для больной ноги это вполне нормально, а вот для остального организма нагрузка окажется чрезмерной. Что если попытаться доставить лекарство только в ногу, не пуская его в остальной организм? Возможно ли это? Да. Такой подход и называется таргетным.
Как же можно сделать так, чтобы лекарство попало только в «больную» ногу и не подвергалось метаболическим трансформациям за пределами ноги? Можно сделать местную инъекцию, а ногу перевязать жгутом. По крайней мере, такой вариант приходит на ум. Но по известным причинам это не лучший вариант. Тем не менее, в данном случае мы сознательно делаем инъекцию в больное место, минуя большинство путей защиты. Можно ли это сделать так же, но не перевязывая ногу, или руку, или голову? Да. Например, если лекарство «упаковать» в «контейнер», который будет путешествовать по организму и откроется только в нужном месте. В настоящий момент применяется несколько вариантов таких контейнеров, в частности, везикулы или фуллерены. Cитуация как при инъекции через шприц. Разница только в том, что место для инъекции выбирает человек, а момент раскрытия контейнера определяется специфической реакцией на «контейнере» с лекарством — именно эта реакция его и раскупоривает. Такой подход потенциально очень эффективен. Лекарство, попав в клетку, остается внутри неё и удерживается мембраной клетки – аналогично лекарству в перевязанной жгутом ноге. Недостаток такого метода — необходимость прорабатывания механизмов «открытия» контейнера. Помочь с этим как раз могут ДНК-оригами.
Технология ДНК-оригами. Устройство и принципы
В ДНК-оригами нуклеотиды применяются вовсе не для хранения или передачи генетической информации и уж тем более не для использования в генной терапии, а как раз для воспроизведения пространственных структур, выполнения логических операций, доставки и катализа действующих веществ.
Поговорим о ДНК и нуклеиновых кислотах в целом. Нуклеиновые кислоты, такие как ДНК и РНК, занимают особое положение среди всех остальных химических соединений в организме. Почему так вышло? Всё из-за того, что нуклеотиды А, Т, Г, Ц, У способны соединяться друг с другом. Они имеют по 2 сайта связывания с образованием фосфодиэфирной ковалентной связи(), а также располагают к образованию связей на основе азотистых оснований. Такая особенность позволяет нуклеиновым кислотам составлять разнообразные конструкции. Эти конструкции могут как переносить информацию, (словно в них реализована письменность с использованием четырёхбуквенного алфавита), так и строить разнообразные геометрические структуры: двойная спираль ДНК, рибосомы, транспортные структуры (тРНК) и многое другое. По сути, клетка приспособлена к генерации внутри себя самых разнообразных сборок, где нуклеотиды используются по принципу конструктора.
Например, на уровне ДНК возможна регуляция многих процессов. Существуют генные сети — такие группы генов, которые координированно функционируют и взаимодействуют друг с другом через РНК и белки. Путём таких взаимодействий можно не только изменить фенотип организма, но и регулировать метаболические процессы. Пример такого взаимодействия — апоптоз (запрограммированная гибель клетки).
Лиганд FasL взаимодействует c Fas-рецептором, локализованным в клеточной мембране. В результате этого происходит активация 4-каспазного каскада – пути передачи сигнала, основанного на взаимной активации протеаз. Этот сигнал и активирует апоптоз. Гены транскрибируются, а затем транслируются, в результате клетка погибает.
ДНК также используется для обеспечения адаптивного иммунитета у бактерий и архей. Такова, например, система CRISPR-Cas9, за исследование которой Дженнифер Даудна и Эммануэль Шарпантье были удостоены Нобелевской премии по химии в 2020 году. У бактерий и архей есть специфические кластерные повторы, которые называются CRISPR, между ними находятся спейсеры. Спейсеры отличаются друг от друга. Более того, они повторяют участки генома некоторых вирусов, атакующих клетку. Cas-белки обнаруживают ДНК/РНК вируса и, если фрагмент «записан» в спейсерном участке, разрезают последовательность «чужака» на кусочки. В эукариотических клетках они также могут работать, поэтому данную систему используют в генной терапии и ГМО-разработках.
И тут есть очень интересный нюанс. Если клетки способны собрать внутри себя различные структуры, используя только нуклеотиды, то и учёные тоже могут это сделать. Например, как инженеры-машиностроители собирают автомобили из различных деталей, так и биоинженеры могут изготавливать «машины», используя методы молекулярной биологии. Технология изготовления наноструктур из нуклеотидов получила название ДНК-оригами.
Биологические принципы ДНК-оригами
Не секрет, что для создания различных ДНК и РНК структур внутри клетки природа разработала ряд процессов, позволяющих манипулировать нуклеотидами. Первым и самым важным процессом является транскрипция.
Транскрипция — это сложный процесс, суть которого сводится к созданию «резервной копии» гена, записанного на цепочке ДНК. Ещё раз напомним, что мы с вами состоим из белков, которые сложены и организованы определённым образом. А белки состоят из определённой последовательности аминокислот. От этой последовательности зависит, какую функцию будет выполнять готовый белок. В свою очередь, для создания нужной последовательности требуется инструкция, по которой в клетке будет производиться сборка белка. Эта инструкция хранится в генах, а гены хранятся в ДНК. Таким образом, ДНК можно сравнить с технической документацией. На производстве работают люди, но есть ли у людей оригинал документации? Нет, только копия, зачастую не одна. На уровне клетки процесс создания копии – это и есть транскрипция, где информация о гене передаётся в новую «временную» последовательность с образованием полинуклеотида РНК. Поскольку единственное назначение такого нуклеотида заключается в том, чтобы кратковременно переносить информацию с главного «документа» к «исполнителям», такая РНК называется «информационной» — (иРНК).
Второй важный в данном контексте процесс — трансляция. Если подбирать популярную аналогию, то трансляция — это процесс создания деталей или машин на производстве по известной технической документации. Единственная поправка тут — это то, что технической документацией является копия ДНК в виде иРНК, а деталями — новые белки. Уже на основе РНК происходит последовательная сборка аминокислот в небольшие пептиды или протяжённые белки.
Ещё один важный процесс — рестрикция. Рестрикция — это разрезание ДНК в определённых местах. Биологический смысл этого процесса очень простой. Например, изменение последовательности нуклеотидов в ДНК путём вырезания лишних кусочков или вовсе порча ДНК. Кстати, таким часто пользуются, например, бактерии, чтобы защищать себя от ДНК-вирусов. Представьте, что на производство медицинской техники проник шпион и подкинул другую документацию с целью изменения производства. Главный технолог смог вовремя обнаружить опасные документы и уничтожить их, пока с них не сняли копию и не отправили на производство.
Исследователи же используют последовательность нуклеотидов в качестве «каркаса» для будущих многомерных структур, которые будут являться своеобразными подложками. В живой клетке такими структурами являются, например, последовательности РНК, соединенные таким образом, что могут переносить аминокислоты внутри клетки. Такие структуры называют транспортными РНК (тРНК). Также есть структуры, в которых происходит синтез белка. По сути, специфическая «машина», куда попадает техническая информация иРНК о том, какой белок нужно сделать, и эта «машина» изготавливает нужный белок из аминокислот, которые транспортируют тРНК. Такие специфические «машины» называются рибосомами и образованы они тоже из нуклеиновых кислот и белков, а именно рРНК.
Как же устроен «каркас» и какие условия важны для сборки? Давайте рассмотрим это на примере транспортной РНК.

Биологическая роль этой молекулы — адресная (специфическая) доставка (активированных) аминокислот в зависимости от кодона во время трансляции белка. Рассказ о том, как образуется «правильный» порядок «кирпичиков» — это материал для отдельной статьи. В данном случае интереснее обсудить, как происходит перетаскивание и доставка аминокислот. Обратите внимание на причудливую форму тРНК. На первый взгляд сложная структура этой молекулы в самом деле напоминает оригами. Учёные назвали такую структуру «клеверным листом». Что позволяет цепи РНК сохранять такую форму? Это принцип комплементарности.
РНК (как и ДНК) состоит из нуклеотидов, которые могут соединяться как последовательно, так и параллельно. Но последовательно могут соединяться любые нуклеотиды через сахарофосфатный остов, а параллельно — только определённые, причём попарно друг с другом через водородные связи (это постулат. Есть мутации и прочие факторы, которые могут его нарушить).

Если вы посмотрите на структуру тРНК, то обнаружите, что в местах, где есть разные нуклеотиды, например A напротив U и G напротив C, сами нити объединены попарно. Нити обёрнуты друг вокруг друга, а нуклеотиды соседних цепочек расположены параллельно. Это означает, что нуклеотиды образуют комплементарные связи. Там, где комплементарность нарушается, образуются пустоты. Это петли 1, 2 и 3.
А теперь самое интересное. Такая цепь тРНК может присоединиться к ЛЮБОЙ другой цепи мРНК. Соединяются они между собой с помощью петли 3 тРНК, на которой находится триплет(3 штуки) нуклеотидов, называемый антикодоном. Антикодон антипараллельный (ориентированный в противоположном направлении) для последовательности мРНК, к которой присоединяется. Таким образом, тРНК может присоединяться к информационной нити РНК только в том месте, где находятся антипараллельные нуклеотиды. Больше нигде. Такое соединение называется «гибридизация ДНК» На противоположном конце тРНК находится аминокислота, которая соответствует кодону информационной РНК, она потом уже будет включаться в реакцию синтеза белка.
Подвергаясь гибридизации, РНК и ДНК могут образовывать структуры разной формы. По сути, стратегии применения могут быть абсолютно разные. Самое интересное, что при этом в большинстве случаев ДНК-оригами сохраняет реакционную способность и может взаимодействовать с окружающими молекулами. Например, к таким структурам можно присоединять лекарства, люминесцентные группы (молекулы, способные светиться под действием возбуждающего света (или другого источника энергии), разнообразные белки.
В сущности, ДНК-оригами — это и есть сборка из ДНК конструкций произвольной формы. При этом конструкции могут быть самые разные. Хоть в форме смайлика, хоть в форме паучка (с ножками из ДНК). Причём конструкции могут находиться как в одной плоскости (двумерные/плоские), так и в нескольких (трёхмерные/объёмные). Просто посмотрите на то, что получилось у биологов.

Надеюсь, теперь принцип строения достаточно понятен. Давайте перейдем от строения и теории к реализованным кейсам. Их достаточно много, все со своими плюсами и минусами. Разберёмся с некоторыми из них.
Примеры использования ДНК-оригами
ДНК-оригами достаточно успешно применили в терапии и диагностике рака. Такое направление, в принципе, довольно перспективно для исследований. Например, учёные поставили такой эксперимент. Они создали ДНК-оригами нескольких форм (треугольник, квадрат, трубка). После этого на полученные фигурки нагрузили доксорубицин (вещество с двоякой активностью: антибиотической и противоопухолевой) и ввели в экспериментальных мышей. Сооруженная конструкция оказалась настоящим оружием массового поражения опухолевых клеток. Причём наиболее высокой активностью отличилась именно треугольная ДНК-оригами. Однако обоснования такому явлению не нашлось.
Особой токсичности это не вызвало, в отличие классической химиотерапии, упомянутой в самом начале. Явление продемонстрировано при лечении рака молочной железы, правда, не у человека, а у мышей. Но принципиально такая безопасная платформа для доставки препарата, собранная из генетического материала впечатляет.
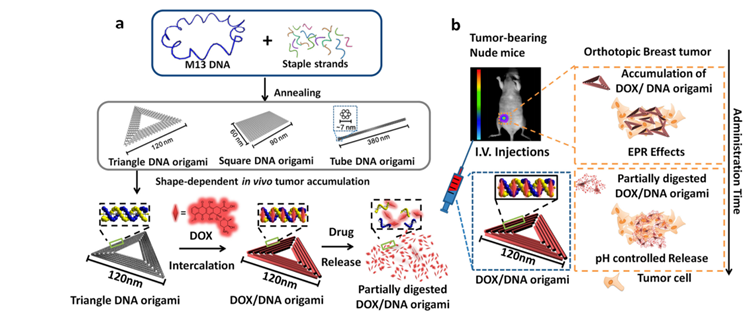
После введения оригами в мышь было продемонстрировано великолепное биораспределение и оптимальное накопление вокруг опухоли. Затем в Оригами интеркалировали доксорубицин в стыковочные узлы (комплементарные пары). Вводили в мышь, оригами доставлялись через кровообращение и накапливались в опухоли благодаря EPR-эффектам (EPR означает «повышенная проницаемость и удержание»). Такая точная и эффективная доставка как раз и должна использоваться в прецизионной медицине.
Второй интересный вариант применения ДНК-оригами — разработка биосенсоров. Это междисциплинарный проект на стыке биологии и электроники. Особенность такого сенсора — возможность определения специфических веществ, которые невозможно определить на основе химико-физических методов. Мы уже знаем, что ДНК-оригами обладает высокой специфичностью к субстрату. В основе сенсорной части вновь лежит гибридизация. Общий принцип данных биосенсоров — изменение какой-либо физической характеристики, произошедшей при гибридизации. Так, при гибридизации ДНК с целевым веществом могут изменяться оптические характеристики растворов или флуоресцентных меток, прикреплённых к ДНК. Может происходить изменение электрической проводимости и многое другое. Датчики, получающие сигнал от биологического агента – ДНК, делят в зависимости от типа преобразователей на оптические, электрические, механические, электрохимические и гравиметрические. В качестве примера можно привести геносенсор.
В упоминаемом здесь исследовании был создан ДНК-аптамер. Он был специфичен для мишени. Более того, аптамер был модифицирован: к нему присоединили считыватель нанопор. Вы, вероятно, помните, что каждый нуклеотид имеет свою структуру. Нанопора разработана для того, чтобы идентифицировать нуклеотиды.
Через нанопору постоянно проходит электрический ток. Как только в пору попадает один из нуклеотидов — фиксируется изменение тока. Ввиду разной структуры нуклеотидов ток по-разному меняется при прохождении разных нуклеотидов. На таком принципе основано нанопоровое секвенирование. Этот метод также позволяет обнаруживать индивидуальные биомаркеры.
Соответственно, модуляция ионного тока через нанопору при перемещении ДНК-оригами принципиально зависит от присутствия биомаркера в полости нанопоры. В исследовании легко обнаруживался С-реактивный белок, самый верный показатель воспаления и/или повреждения живых тканей. А значит, при возможной дополнительной модификации оригами реализуема и специфическая адресная доставка.
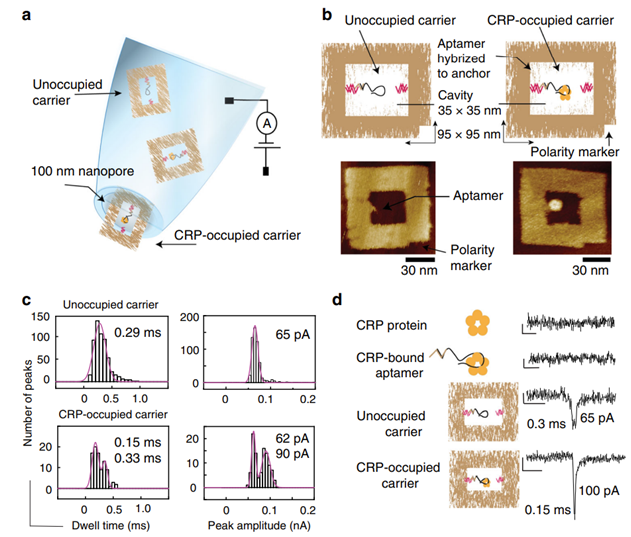
Слева показано, как работает оригами-биосенсор. Справа показан сенсор в двух состояниях: занятый и не занятый биомаркером.
Наконец, третий пример: ДНК-оригами оказалось весьма действенным средством в борьбе с почечной недостаточностью. В медицине N-ацетилцистеин считается универсальным препаратом для такой болезни. К сожалению, он не всегда может помочь. Часто приходится прибегать к удалению или трансплантации почки и использованию поддерживающей терапии. Исследователи вновь создали несколько форм ДНК-оригами (трубчатая, треугольная и прямоугольная), пометили радиоактивными изотопами (для детекции местоположения) и ввели в больную мышь. Оригами эффективно накапливались в почках. Более того, они показывали терапевтический эффект, причём эффект от использования прямоугольных структур оказался сопоставимым с воздействием N-ацетилцистеина. Терапевтический эффект возникал потому, что оригами способны поглощать АФК (активные формы кислорода), которые являются токсичными для организма, и тем самым ослаблять окислительный стресс. Ещё один инструмент медикам в арсенал.

Возможности применения ДНК-оригами в ближайшем будущем
На сегодняшний день уже разработано и продемонстрировано множество кейсов применения ДНК-оригами, но, как мы знаем, нет предела совершенству и технологические возможности постоянно расширяются. В дальнейшем планируется ещё больше увеличить точность, скорость сборки оригами, а также стабильность получаемых конфигураций.
В будущем программы для проектирования и сборки ДНК-оригами будут доступны для использования обычным людям, даже не обладающим глубокими познаниями в биологии. Проектирование и сборка ДНК-оригами достаточно хорошо оптимизируется. Такой подход называют молекулярным программированием. Уже сейчас существуют программные пакеты для проектирования и разработки всевозможных ДНК-конструкций. (https://github.com/estherlin/dna-origami) и для их оптимизации (https://github.com/cmhuang2011/MagicDNA).
Это направление не перестаёт развиваться, поэтому рано или поздно процесс сборки и моделирования ДНК-оригами может быть полностью автоматизированным .
Также ведутся исследования по внедрению ДНК-оригами в структуру молекулярных роботов. Это самый интересный кейс, ведь именно тут сплетаются множество направлений науки: от электроники и IT до биологии. Наконец, наиболее впечатливший меня пример – конструирование шаперонов. Поскольку ДНК-оригами уже поддаются воспроизведению с большой точностью, на них можно подвесить большое количество функциональных молекул, а соответственно, интегрировать множество функций. Многофункциональность как раз является одной из важных особенностей нанороботов. Как минимум им необходимо перемещение, возможность загрузки (веществ), точное взаимодействие с объектом и изменение состояния объекта. Уже показано, что нанороботы, собранные на основе ДНК-оригами, могут выполнять механический синтез молекул, ориентируя их нужным образом и сближая друг с другом. Вполне возможно, что в будущем будут получены готовые каталитические структуры на основе ДНК-оригами, которые будут стимулировать реакции между молекулярными компонентами и, возможно, даже вносить какие-то из компонентов конформационные изменения. Я думаю, что это будет что-то наподобие шаперонов и шаперонинов.
Также планируется создание бактериальных штаммов, способных к воспроизводству ДНК-оригами. Стоит верить в то, что это направление разовьётся, хотя бы потому, что уже было показано, что бактерии с неестественными парами оснований (нуклеотидов) могут успешно размножаться. Уже известны некоторые попытки создать продуцентов простейших ДНК-оригами. В дальнейшем исследователи надеются открыть возможность для эволюционной оптимизации, которая привела бы к созданию ещё более сложных структур с совершенно новыми функциональными возможностями. Уже получены бактерии, синтезирующие человеческий инсулин и другие гормоны. Коль скоро мы научились этому, то почему не сможем воспроизвести оригами?
Возможно, скептически настроенному читателю такая технология может показаться достаточно сырой и неготовой конкурировать с другими разработками. Может быть, она даже воспринимается как научно-фантастическая. Однако в биологии нередки случаи, когда максимально бесполезные на первый взгляд исследования приводили к серьёзным достижениям, как в случае с применением агробактерий при исследовании опухолей у растений. Более того, такая технология медленно, но верно раскручивается и проявляет всё большую эффективность, превращаясь из футуристичной в актуальную.
Сейчас, когда любому исследователю понятно, что изучение молекулярной структуры является ключевым в понимании функций любого биологического процесса, особенно полезна возможность собирать молекулы разнообразных форм. Ведь от формы молекулы могут зависеть множество функций, и с этой точки зрения метод ДНК-оригами оказывается как никогда кстати. Вероятно, ДНК-оригами позволит расширить биосовместимость и биодоступность многих лекарств, удешевить процесс сборки сенсоров и выйти на новый уровень развития в медицине и электронике.






