Все мы знаем, что если надуть пластиковую бутылку горячим воздухом, крепко-накрепко закрыть крышкой, а потом охладить, то бутылка сожмётся. Причина этого лежит в физике 8-го класса, или, если точнее, в законе Гей-Люссака, утверждающем, что отношение объёмов при разных температурах равно отношению абсолютных температур. То есть ещё со школьных времён (а может и раньше) нам всем известно, что при нагревании некоторого количества газа его объём увеличивается, а при охлаждении — уменьшается.
А что насчёт того, из чего этот газ состоит? Увеличивается ли объём самих частичек газа, то есть размер атомов и молекул? Банальный ответ на этот банальный вопрос под катом.

Ответ на этот вопрос весьма прост: как мы определимобъём размер частиц (что такое размер атома/молекулы в зависимости от температуры), такой ответ мы и получим. Поскольку атомы по-своей сути — это одноатомные молекулы, то дальше мы будем называть все эти частицы единым термином "молекула".
Если взять бутылку с газом, и из этой бутылки взять одну единственную молекулу, то окажется, что для неё не возможно (по-честному) даже принципиально измерить температуру. Частица находится в каком-то конкретном (квантовом) состоянии, которое мы можем определить и измерить, но при этом мы не сможем засунутьей в в неё термометр и узнать сколько там у неё градусов. Связанно это с тем, что «температура» — это свойство макроскопических (т.е. больших) систем, состоящих из большого числа частиц. А значит если молекул в системе мало, то и измерять у этой системы нечего. «Большое число частиц», конечно, это плавающее понятие, но обычно оно измеряется в молях, или в числах Авогадро ( ), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
Но что вообще такое температура? Ещё со школы мы знаем, что есть т.н. абсолютная температура T, измеряемая в градусах Кельвина. Именно она стоит во всех газовых законах, в частности в уравнении Менделеева-Клайперона.
Абсолютная температура связанна с относительной температурой t, измеряемой в градусах Цельсия, как , и абсолютный ноль (T=0, или же
, и абсолютный ноль (T=0, или же  ) — это недостижимая величина. Ещё всем в голову вбивают мантру:
) — это недостижимая величина. Ещё всем в голову вбивают мантру:
Но эта мантра не объясняет, что же именно из себя представляет температура.
Попробуем разобраться. Начнём с простого примера. Закроем глаза и представим себе Африку: жаркую, солнечную, заполненную равнинными саваннами, и с горой Килиманджаро торчащей посередине. А ещё там есть слоны.
Каждый слон имеет определённую (большую) массу, и поэтому любое поднятие своей туши из равнинной местности в горную — это большая затрата энергии.
Представим, что слоны голодные, поэтому энергии у них мало. Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.

А теперь представим, что слоны хорошенько поели, да ещё какой-нибудь [Роскомнадзор] ещё для скорости им в еду подсыпали, так что энергии у слонов много. В этом случае, что равнина, что гора, слоны будут туда переться без особой устали, поэтому теперь вероятность отыскать слона на равнине и в горах будет отличаться уже меньше, чем в предыдущем примере (см. картинку ниже), хотя всё ещё будет сохраняться правило: чем выше на гору — тем меньше слонов.

Эти два примера весьма точно иллюстрируют случаи газа с низкой (первый) и высокой (второй) температурой. У каждой молекулы (слона) есть какая-то своя энергия, в нашем примере — это гравитационная энергия , где m — масса, g = 9.8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
, где m — масса, g = 9.8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
Теперь, собственно, можно перейти к вопросу: а растут ли, например, атомы при росте температуры. Само собой, каждый конкретный атом находится в каком-то квантовом состоянии, поэтому от температуры его размер не зависит, но вот средний размер всех атомов в сосуде с газом от той самой температуры зависеть уже будет.
Представим себе, например, атом водорода: тяжёлый протон, а вокруг него летает электрон. Поскольку протон положительный, а электрон отрицательный, то один притягивает другой по закону Кулона, который выглядит точно так же как ньютоновская гравитация, поэтому в этом смысле атом вполне себе напоминает, например, Солнце и Землю, летающую вокруг него. Только, как говорит нам (далеко не полностью удачная, см. например, тут) атомная модель Бора, в отличие от системы «звезда + планета», электрон летает вокруг ядра только по орбитам определённого радиуса.

Так или иначе, чем больше энергии мы закачиваем в атом водорода, тем более широкая орбита будет доступна электрону для полёта вокруг ядра. Естественно, если мы возьмём один конкретный атом, мы можем узнать его орбиту, и она ничего нам о температуре всех атомов не скажет. Но вот если мы измерим радиусы у множества атомов, а потом усредним полученные величины, то у нас действительно возникнет зависимость от температуры для этого среднего числа. В результате получится что-то типа такой картинки:
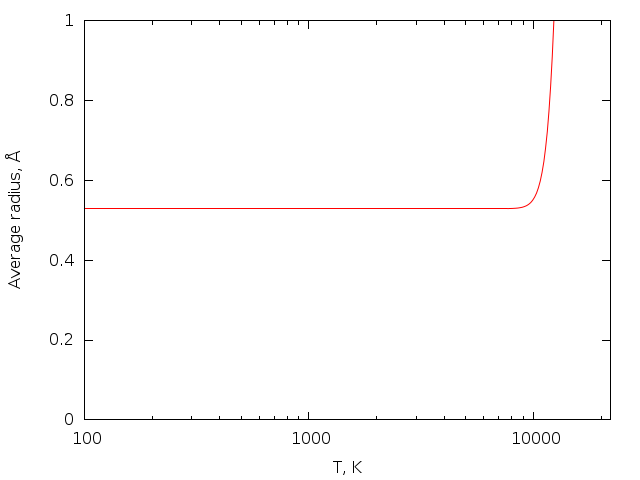
Из неё видно, что чтобы начать замечать хоть какие-то изменения в размере электронной оболочки, нужно ооочень сильно нагреть атом (в данном случае до более 10000 градусов). Это в целом общий тренд.
Иными словами, ответ на вопрос поста: да, при нагревании электронные оболочки атомов (и молекул) в среднем расширяются. Но, это увеличение очень маленькое, и требует нагрева до очень высоких температур, к которым мы в обыденной жизни не привыкли.
Теперь зададимся вопросом: а что если наша молекула составлена не из одного, а из двух, трёх или более атомов? Можем ли мы что-то сказать о межатомных расстояниях в ней, как ведут они себя при повышении температуры? Для простоты, естественно, ограничимся двухатомными молекулами, кои, в частности, составляют как минимум 98.7 % нашей атмосферы (азот и кислород).
У нас есть один атом, у нас есть второй атом: ммммм, и расстояние между ними, обозначим его как R. Как ведёт себя потенциальная энергия взаимодействия этих атомов в зависимости от R?
В итоге мы понимаем, что кривая потенциальной энергии взаимодействия имеет следующий вид:
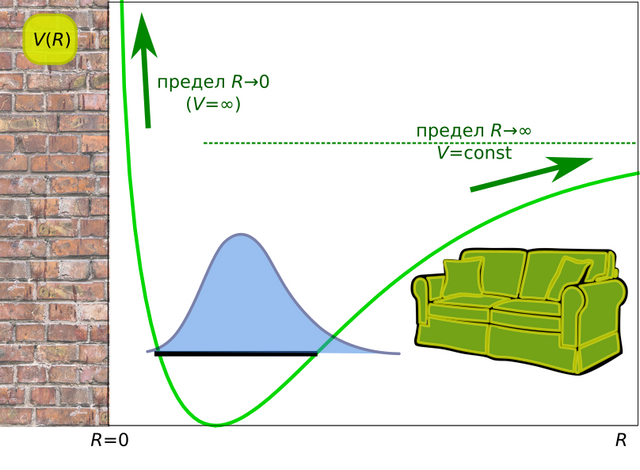
Атомы в молекуле всегда колеблются, даже при абсолютном нуле, когда никакой лишней энергии не осталось. Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале исдохнуть лежать, свернувшись калачиком: им приходится совершать т.н. нулевые колебания. Если же энергия у них выше, то и колеблются они с большей амплитудой. Поэтому возникает вопрос: а как конкретно колеблются атомы?
Если бы слева и справа от точки минимума потенциал был одинаков, как, например, в случае закона Гука, то атомы во время колебаний отклонялись бы в область малых значений межатомных расстояний ровно то же количество времени, сколько и в область больших значений. В этом случае бы среднее значение межатомного расстояния при любой температуре было бы равно значению расстояния в точке минимума. Иными словами, если бы мы взяли газ, и в любой момент времени сфоткали все молекулы, а потом посчитали бы среднее значение для всех расстояний между атомами, то в итоге получили бы расстояние в точке минимума.
Но реальность у нас другая: слева от точки минимума (при R → 0) у молекулы стоит жёсткая стенка, а справа (при R → ∞) — мягкий диван. Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
К сожалению, чтобы посчитать этот рост среднего расстояния, потребуется много больше усилий, чем в случае атома водорода. Но можно пойти другим путём, и поискать, а не исследовался ли этот вопрос в экспериментах?
И порывшись на просторах этих наших Интернетов, можно набрести на следующую работу: J. Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
В результате они, в частности, получили следующую зависимость средней длины двойной связи C=O в молекуле углекислого газа (O=C=O):
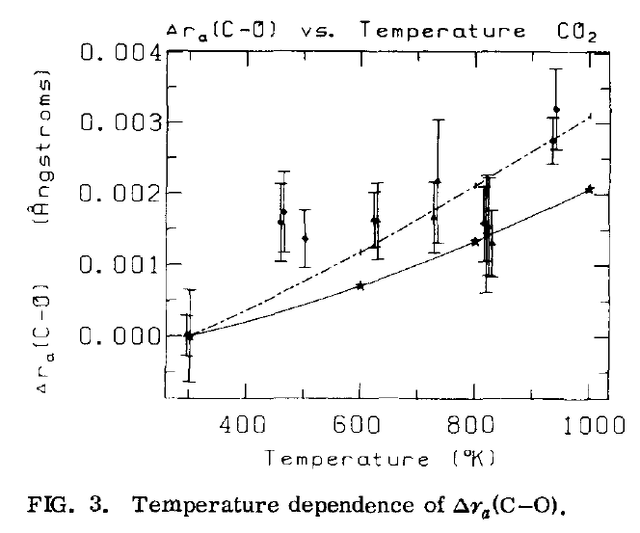
Из графика видно, что при нагреве от комнатной температуры до 1000 градусов К это среднее значение выросло почти на 0.004 Å (1 ангстрем, Å, = 10—10 метров). Конечно, в наших привычных величинах это очень мало, но сама длина связи C=O в этой молекуле составляет 1.2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
Да хотя бы просто ради любопытства. Разве не прикольно поспорить с коллегой на чашку кофе, что при нагреве контейнера с едой в микроволновке помимо объёма газа увеличится и размер частиц газа? Ну и в практическом смысле это тоже важно. Все эти температурные расширения/уменьшения всяких макроскопических объектов, таких как рельсы, провода линий электропередач, да даже крышки банки под горячей водой, работают ровно по тому же механизму, что и для молекул газа: средние межатомные расстояния увеличиваются, т.к. в систему при увеличении температуры закачивается больше энергии движения частиц. И по-моему, осознание того, что за такими обыденными явлениями стоят такие нетривиальные процессы, вдохновляет на новые подвиги и свершения.
Всех благ, и да пребудет с Вами межатомная сила.
А что насчёт того, из чего этот газ состоит? Увеличивается ли объём самих частичек газа, то есть размер атомов и молекул? Банальный ответ на этот банальный вопрос под катом.

Ха-ха, попались!
Ответ на этот вопрос весьма прост: как мы определим
Если взять бутылку с газом, и из этой бутылки взять одну единственную молекулу, то окажется, что для неё не возможно (по-честному) даже принципиально измерить температуру. Частица находится в каком-то конкретном (квантовом) состоянии, которое мы можем определить и измерить, но при этом мы не сможем засунуть
Что такое температура?
Но что вообще такое температура? Ещё со школы мы знаем, что есть т.н. абсолютная температура T, измеряемая в градусах Кельвина. Именно она стоит во всех газовых законах, в частности в уравнении Менделеева-Клайперона.
Для забывших, как выглядит уравнение Менделеева-Клайперона
Это уравнение имеет вид  , где P — давление, V — объём, n — количество вещества (в молях), R = 8.314 Дж/(моль · К) — универсальная газовая постоянная, а T — абсолютная температура в Кельвинах (К).
, где P — давление, V — объём, n — количество вещества (в молях), R = 8.314 Дж/(моль · К) — универсальная газовая постоянная, а T — абсолютная температура в Кельвинах (К).
Абсолютная температура связанна с относительной температурой t, измеряемой в градусах Цельсия, как
абсолютная температура является мерой средней кинетической энергии молекул.
Но эта мантра не объясняет, что же именно из себя представляет температура.
Попробуем разобраться. Начнём с простого примера. Закроем глаза и представим себе Африку: жаркую, солнечную, заполненную равнинными саваннами, и с горой Килиманджаро торчащей посередине. А ещё там есть слоны.
Каждый слон имеет определённую (большую) массу, и поэтому любое поднятие своей туши из равнинной местности в горную — это большая затрата энергии.
Представим, что слоны голодные, поэтому энергии у них мало. Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.

А теперь представим, что слоны хорошенько поели, да ещё какой-нибудь [Роскомнадзор] ещё для скорости им в еду подсыпали, так что энергии у слонов много. В этом случае, что равнина, что гора, слоны будут туда переться без особой устали, поэтому теперь вероятность отыскать слона на равнине и в горах будет отличаться уже меньше, чем в предыдущем примере (см. картинку ниже), хотя всё ещё будет сохраняться правило: чем выше на гору — тем меньше слонов.

Эти два примера весьма точно иллюстрируют случаи газа с низкой (первый) и высокой (второй) температурой. У каждой молекулы (слона) есть какая-то своя энергия, в нашем примере — это гравитационная энергия
Распределение Больцмана
Собственно, распределение Больцмана имеет вид:
где n(E) — это число частиц с энергией E, R — универсальная газовая постоянная (см. предыдущий спойлер), а T, само собой, температура.
В примере же со слонами мы иллюстрировали т.н. барометрическую формулу: частный случай распределения Больцмана, показывающий как меняется давление газа с увеличением высоты:
где P(h) — это давление на высоте h, , а M — это молярная масса газа.
, а M — это молярная масса газа.
где n(E) — это число частиц с энергией E, R — универсальная газовая постоянная (см. предыдущий спойлер), а T, само собой, температура.
В примере же со слонами мы иллюстрировали т.н. барометрическую формулу: частный случай распределения Больцмана, показывающий как меняется давление газа с увеличением высоты:
где P(h) — это давление на высоте h,
Растут ли атомы от температуры?
Теперь, собственно, можно перейти к вопросу: а растут ли, например, атомы при росте температуры. Само собой, каждый конкретный атом находится в каком-то квантовом состоянии, поэтому от температуры его размер не зависит, но вот средний размер всех атомов в сосуде с газом от той самой температуры зависеть уже будет.
Представим себе, например, атом водорода: тяжёлый протон, а вокруг него летает электрон. Поскольку протон положительный, а электрон отрицательный, то один притягивает другой по закону Кулона, который выглядит точно так же как ньютоновская гравитация, поэтому в этом смысле атом вполне себе напоминает, например, Солнце и Землю, летающую вокруг него. Только, как говорит нам (далеко не полностью удачная, см. например, тут) атомная модель Бора, в отличие от системы «звезда + планета», электрон летает вокруг ядра только по орбитам определённого радиуса.

Так или иначе, чем больше энергии мы закачиваем в атом водорода, тем более широкая орбита будет доступна электрону для полёта вокруг ядра. Естественно, если мы возьмём один конкретный атом, мы можем узнать его орбиту, и она ничего нам о температуре всех атомов не скажет. Но вот если мы измерим радиусы у множества атомов, а потом усредним полученные величины, то у нас действительно возникнет зависимость от температуры для этого среднего числа. В результате получится что-то типа такой картинки:

Из неё видно, что чтобы начать замечать хоть какие-то изменения в размере электронной оболочки, нужно ооочень сильно нагреть атом (в данном случае до более 10000 градусов). Это в целом общий тренд.
Как была посчитана эта зависимость
Подробнее о формулах можно узнать в этом посте.
Если кратко, то радиус орбиты (R) в зависимости от главного квантового числа n=1,2,3… — это
где R0=5.3×10−11 метра − это боровский радиус. Энергия (E) же орбиты имеет вид
где Eh= 4.3597447222071(85)×10−18 Джоулей − это энергия Хартри.
Далее используя распределение Больцмана для одной частицы, мы можем посчитать среднее значение радиуса от температуры как
Знаменатель у нас появляется из-за того, что полная вероятность всех исходов измерений должна быть равна единице.
Если кратко, то радиус орбиты (R) в зависимости от главного квантового числа n=1,2,3… — это
где R0=5.3×10−11 метра − это боровский радиус. Энергия (E) же орбиты имеет вид
где Eh= 4.3597447222071(85)×10−18 Джоулей − это энергия Хартри.
Далее используя распределение Больцмана для одной частицы, мы можем посчитать среднее значение радиуса от температуры как
Знаменатель у нас появляется из-за того, что полная вероятность всех исходов измерений должна быть равна единице.
Иными словами, ответ на вопрос поста: да, при нагревании электронные оболочки атомов (и молекул) в среднем расширяются. Но, это увеличение очень маленькое, и требует нагрева до очень высоких температур, к которым мы в обыденной жизни не привыкли.
Растут ли молекулы от температуры?
Теперь зададимся вопросом: а что если наша молекула составлена не из одного, а из двух, трёх или более атомов? Можем ли мы что-то сказать о межатомных расстояниях в ней, как ведут они себя при повышении температуры? Для простоты, естественно, ограничимся двухатомными молекулами, кои, в частности, составляют как минимум 98.7 % нашей атмосферы (азот и кислород).
У нас есть один атом, у нас есть второй атом: ммммм, и расстояние между ними, обозначим его как R. Как ведёт себя потенциальная энергия взаимодействия этих атомов в зависимости от R?
- Если мы разведём атомы оооочень далеко друг от друга, то химическая связь между ними давно будет разорвана. Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
- Если же, наоборот, мы будем пытаться впихнуть один атом в другой (R → 0), то в какой-то момент мы выгоним из пространства между этими атомами все электроны, ибо те не идиоты, чтобы тусоваться в токсичной высокоэнергетической атмосфере, и у нас останутся два голых положительно заряженных ядра, отталкивающиеся друг от друга через Кулоновскую силу. Т.е. при R → 0 у нас будет вертикальная асимптота, стремящая потенциальную энергию взаимодействия атомов в высокоэнергетическую бесконечность.
- Ну и, логично, что не будь какого-то минимума на этой потенциальной кривой между R=0 и R → ∞, то самих молекул о которых мы говорим, не существовало бы.
В итоге мы понимаем, что кривая потенциальной энергии взаимодействия имеет следующий вид:

Атомы в молекуле всегда колеблются, даже при абсолютном нуле, когда никакой лишней энергии не осталось. Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале и
Если бы слева и справа от точки минимума потенциал был одинаков, как, например, в случае закона Гука, то атомы во время колебаний отклонялись бы в область малых значений межатомных расстояний ровно то же количество времени, сколько и в область больших значений. В этом случае бы среднее значение межатомного расстояния при любой температуре было бы равно значению расстояния в точке минимума. Иными словами, если бы мы взяли газ, и в любой момент времени сфоткали все молекулы, а потом посчитали бы среднее значение для всех расстояний между атомами, то в итоге получили бы расстояние в точке минимума.
Но реальность у нас другая: слева от точки минимума (при R → 0) у молекулы стоит жёсткая стенка, а справа (при R → ∞) — мягкий диван. Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
К сожалению, чтобы посчитать этот рост среднего расстояния, потребуется много больше усилий, чем в случае атома водорода. Но можно пойти другим путём, и поискать, а не исследовался ли этот вопрос в экспериментах?
И порывшись на просторах этих наших Интернетов, можно набрести на следующую работу: J. Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
- брали кучу молекул углекислого газа (CO2) и нагревали их до разных температур, в диапазоне температур от комнатной (300 K ≈ 25oC) до «ай как горячо» (1000 К ≈ 730oC ),
- при каждой выбранной температуре делали «фотку» всех молекул при помощи электронов (этот метод зовётся газовой электронографией, о нём можно немного почитать здесь),
- ну а дальше буквально измеряли средние значения для межатомных расстояний на каждой фотке.
В результате они, в частности, получили следующую зависимость средней длины двойной связи C=O в молекуле углекислого газа (O=C=O):

Из графика видно, что при нагреве от комнатной температуры до 1000 градусов К это среднее значение выросло почти на 0.004 Å (1 ангстрем, Å, = 10—10 метров). Конечно, в наших привычных величинах это очень мало, но сама длина связи C=O в этой молекуле составляет 1.2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
Зачем это вообще знать?
Да хотя бы просто ради любопытства. Разве не прикольно поспорить с коллегой на чашку кофе, что при нагреве контейнера с едой в микроволновке помимо объёма газа увеличится и размер частиц газа? Ну и в практическом смысле это тоже важно. Все эти температурные расширения/уменьшения всяких макроскопических объектов, таких как рельсы, провода линий электропередач, да даже крышки банки под горячей водой, работают ровно по тому же механизму, что и для молекул газа: средние межатомные расстояния увеличиваются, т.к. в систему при увеличении температуры закачивается больше энергии движения частиц. И по-моему, осознание того, что за такими обыденными явлениями стоят такие нетривиальные процессы, вдохновляет на новые подвиги и свершения.
Всех благ, и да пребудет с Вами межатомная сила.