Основной целью применения лекарственных препаратов, замедляющих процесс старения, является удлинение здоровой и активной жизни человека. Последнее в свою очередь направлено на улучшение экономического благосостояния быстро стареющего населения планеты. Чтобы какое-либо фармакологическое вмешательство получило всеобщее одобрение, лекарственные препараты должны быть эффективными у любого взрослого человека и иметь хороший профиль безопасности. В настоящей статье мы показали, что с помощью уже известных науке препаратов нам удалось значительно увеличить продолжительность жизни C.elegans. Увеличение жизни червей было достигнуто за счет изменения активности нескольких связанных со старением эволюционно консервативных сигнальных путей. Благодаря влиянию на разные сигнальные пути с общим синергическим эффектом, мы надеемся, что сможем замедлить процесс старения человека, удвоить продолжительность жизни, а также более, чем в два раза увеличить длительность здорового периода жизни, без компенсаторных изменений в физическом развитии и активности.
Насколько нам известно, продолжительность жизни нематод C.elegans, достигнутая на взрослых организмах с помощью лекарств была самой высокой в нашей работе. Мы применяли лекарственные препараты, изначально предназначенные для терапии разных заболеваний взрослых людей. Разработка метода, основанного на использовании уже одобренных препаратов, действующих одновременно на несколько сигнальных путей, связанных со старением, считается очень перспективной. Она может привести к предотвращению развития возраст-зависимых заболеваний и физической астении пожилого населения мира, которое стремительно стареет.
Одним из наиболее важных этапов в науке о старении стало открытие эволюционно-консервативных сигнальных путей, отвечающих за регуляцию продолжительности жизни организма. Мутации в генах, затрагивающих эти сигнальные пути, могут привести к удлинению продолжительности жизни от 30 до 100% у модельных организмов. Сочетанные генные мутации способны вызвать синергический эффект, увеличивающий срок жизни. Эффект от фармакологических вмешательств обычно намного слабее, чем от генетических мутаций, даже, если они действуют на одни и те же сигнальные пути.
Наличие синергического эффекта при нескольких сочетанных генных нарушениях наводит нас на мысль, что возможным перспективным направлением в будущем станет использование таких лекарственных препаратов, которые одновременно будут влиять на несколько эволюционно-консервативных сигнальных путей. На сегодняшний день зарегистрировано немного данных о синергическом эффекте при применении лекарственных препаратов, направленных на увеличение продолжительности жизни. В данной работе, мы сообщаем о результатах нового исследования выполненного в условиях in vivo, в котором использовались такие лекарственные препараты. Мы продемонстрировали, как комбинация из препаратов может максимально увеличить эффект терапии за счет того, что они действуют на несколько сигнальных путей, с взаимно усиливающим эффектом друг друга. При этом получилось снизить до минимума частоту побочных реакций и ¬уровень компенсаторных нарушений в развитии организма, поскольку осуществлялись точечные изменения в отдельных, но взаимодействующих между собой сигнальных путях. Конечной целью исследования была разработка схемы фармакологической терапии взрослого населения, с доказанным на процесс старения эффектом, которой равнялся эффекту от мутаций, или же превышал его.
Так как общепризнанных биологических маркеров старения немного, в настоящее время, для того, чтобы оценить результаты выполненного исследования, сравнивают просто общую продолжительность жизни организмов. В качестве короткоживущего модельного организма использовалась нематода вида Caenorhabditis elegans. Далее мы подобрали несколько комбинаций препаратов, таким образом, что были созданы 2 группы лекарств, в каждой из которых насчитывалось по три препарата. Как было ранее опубликовано в исследованиях, при применении этих комбинаций препаратов отмечалась значительная разница в увеличении продолжительности жизни и удлинении здоровой жизни нематод C.elegans.
Синергический эффект, полученный при действии комбинации препаратов, оказался сравним с тем, который наблюдался после направленных мутаций в общеизвестных генах, связанных со старением. Мы не выявили никаких компенсаторных нарушений в развитии организмов из тех, которые часто встречаются и ассоциированы с фармакологическим вмешательством. Нам удалось косвенно определить, что лекарственная терапия замедляла скорость естественного старения, поскольку уровень некоторых маркеров повышался. Кроме того, мы пришли к выводу, что TGFβ (Трансформирующий фактор роста β1) являлся ключевым фактором, обеспечивающим синергический эффект сигнального пути. Дополнительно, в исследовании было показано, что у нематод, пролеченных вышеуказанными комбинациями препаратов, соотношение мононенасыщенных липидов к полиненасыщенным изменилось сторону преобладания первых (возрастание соотношения MUFA к PUFA), а уровень перекисного окисления мембранных липидов снизился. Наконец, мы подтвердили, что подобный синергический эффект определялся также и у плодовых мушек вида Drosophila melanogaster.
Выбор сигнальных путей и мишеней в C. Elegans.
На основе современной научной литературы, мы нашли несколько эволюционно-консервативных сигнальных путей и механизмов, связанных со старением (Вспомогательный материал, таблица S1). Среди выбранных нами мишеней и механизмов были: АМФ-активируемая протеинкиназа, c-Jun-N-терминальная киназа (JNK), мишень рапамицина млекопитающих (mTOR) и механизмы, задействованные в процессах: ограничения калорий (CR), митогомезиса (действие малых доз веществ, которые в больших дозах являются токсичными) и митохондриального метаболизма. Вышеописанные мишени и процессы считаются основными в регуляции сигнальных путей продлевающих жизнь. Для каждого сигнального пути были определены лекарственные препараты, влияние которых на долголетие описано, по крайней мере, у одного из известных модельных организмов (нематод, плодовых мушек или мышей).
Препараты, проверенные на людях, представляли особый интерес для нас. Поэтому мы отдали предпочтение лекарственным соединениям с заявленной эффективностью у млекопитающих или одобренных у человека. Первоначально мы нашли 11 потенциальных препаратов соответствующих вышеописанным критериям (Вспомогательная таблица S1). Мы добавили в наш список аллантоин на основе отчета о его способности продлевать жизнь у C.elegans и результатов транскрипционного анализа. У нас есть подозрения, что механизм его действия отличается от остальных веществ. Чтобы избежать ошибок в измерении продолжительности жизни организмов после применения препаратов, сначала мы тестировали слепым методом исполнителя работ. Основной причиной для этого послужил тот факт, что результаты исследования могут сильно зависеть от правильности условий эксперимента и значительно отличаться среди разных лабораторий. Мы использовали только те дозы препаратов, которые ранее были описаны в научных работах. Эффективность пяти препаратов, влияющих на продолжительность жизни, неоднократно была подтверждена в условиях нашей лаборатории (рис.1, вспомогательная таблица S2). Как правило, �� нашем исследовании эффективность соединений, ассоциированных с увеличением жизни организмов, была несколько меньше, чем в опубликованных прежде работах (Дополнительная схема 1, вспомогательная таблица S2).

Рис. 1
Чтобы оценить эффективность действия препаратов в исследовании, мы выполнили транскриптомный анализ и определи дифференционально экспрессированные гены (DEG) и провели обогащение сигнальных путей по отношению к контролю. Мы заметили определенные отличия в экспрессии генов и активности сигнальных путей в экспериментальной группе, которых не было в контрольной группе. Наиболее существенные изменения в экспрессии генов и работе сигнальных путей были вызваны действием одной комбинации препаратов, состоящей из рифампицина, рапамицина и psora-4 (PSORA), где последний препарат вводился после первых двух. В отличие от упомянутых препаратов, метформин (MET) и аллантоин (ALLAN) влиял на экспрессию меньшего количества генов (Схема 2а, вспомогательная таблица S3).
Анализ транскрипционных результатов показал, что каждое лекарственное вещество имело свой уникальный профиль измененных им генов. В тоже время часть этих генов также была обнаружена в транскрипционных профилях остальных препаратов (Схема 2а). Так, MET действовал на работу многих «популярных» генов, но количество, вовлеченных уникальных генов у него было минимальным. Препараты МЕТ и PSORA меняли активность почти всего спектра «популярных» генов, на часть из которых также по отдельности влияли препараты, приведенные в Схеме 2а.
Соединение ALLAN затрагивало наименьшее число генов, зато большая часть из них принадлежала к уникальной группе. Менее половины его генов было представлено в транскрипционном спектре других лекарственных препаратов. Эффект от применения RIF и RAP значительно отличался друг от друга и от любых других лекарств. Основываясь на трех критериях метода главных компонент (PCA), мы пришли выводу, что RIF, RAP и PSORA были очень обособлены от остальных препаратов. Напротив, эффекты от воздействия ALLAN и MET являлись более вариабельными, но очень схожими между собой. Кроме того, их результаты были несколько приближенными к результатам контрольной группы.
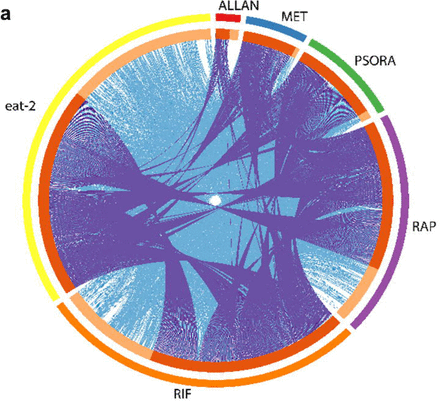




Рис.2
На следующем этапе, мы определили, как влияют различные лекарственные комбинации на время жизни нематод. Поскольку действия MET и RAP легче перенести на человека, эти препараты нами были изучены в первую очередь. Однако, оказалось, что комбинация MET и RAP в оптимальных дозах 50мг и 100мг, не привела к еще большему удлинению продолжительности жизни (Дополнительная схема 2 J,P). Мы выполнили еще несколько исследований с использованием всех возможных комбинаций этих препаратов в оптимальных и полуоптимальных дозах (Дополнительная схема 2 J-P).
Результатом применения MET и RAP в их полуоптимальных дозах стало увеличение максимума срока жизни нематод (Схема 2е, Дополнительная схема 2 m,s), но не среднего значения продолжительности жизни (Дополнительная схема, 2p). Это незначительное преимущество MET и RAP согласуется с выводами другого исследования на мышах. В нем доказано, что добавление MET к RAP главным образом продляло жизнь самцам, а у самок результат был малозаметным (когда он вообще регистрировался).
Далее мы последовательно выяснили эффекты 10-ти комбинаций лекарств. В каждой комбинации лекарств было два препарата из пяти возможных (Дополнительная схема 2 a-i). Анализ синергического эффекта осуществлялся с помощью HSA- модели (Higher Single Activity model), оценивающей степень активности одного из двух лекарств.
Результат от сочетанного применения различных лекарств, считался, как синергический, при условии, что он сильно превышал результат, полученный от действия каждого препарата по отдельности и тогда, когда дозы лекарств были одинаковыми. Учитывая вышеупомянутое определение, мы установили, что только у двух из десяти комбинаций лекарств наблюдался синергический эффект (схема 2c, d, дополнительная схема 2 и вспомогательная таблица S2), зафиксированный при сочетании препаратов: RIF с RAP и RIF c PSORA. С данными препаратами можно было составить три различные лекарственные комбинации, но только две из них больше всего отличались друг от друга по результатам PCA-анализа. Именно у последних двух был выявлен синергический эффект (Схема 2b, дополнительная схема 4a,b).
Среди оставшихся 8 пар лекарственных препаратов, эффект на продолжительность жизни у 4-х был таким же, как у наиболее эффективного препарата в соответствующей лекарственной комбинации. В 4-х других комбинациях эффект одного лекарства взаимно исключал действие другого. В последнем случае, также отмечалось отсутствие токсических реакций и увеличения срока жизни (Дополнительная схема 2, вспомогательная таблица S2).
В нашем исследовании использование двух комбинаций лекарственных препаратов с синергическим эффектом привело к более значительному удлинению жизни, по сравнению с данными, опубликованными ранее в научной литературе. Однако, прирост продолжительности жизни после лекарственного применения оказался меньше, чем подобный эффект от мутационных нарушений. В связи с этим у нас возникли вопросы: являются ли настоящие показатели выживаемости максимумом, которого можно достичь при лекарственном лечении взрослых животных? Получим ли мы дополнительное увеличение периода жизни за счет добавления других соединений? Если комбинация препаратов будет включать три лекарственных соединения, тогда число возможных сочетаний возрастает до 30. У нас не было возможности проверить такое количество комбинаций препаратов.
Поэтому мы выборочно изучили действие некоторых тройных комбинаций препаратов. В первую очередь нами была рассмотрена комбинация препаратов, в которой все три лекарственных соединения больше всего отличались между собой на основании критериев PCA-метода. Еще одним условием являлось наличие у препарата синергического эффекта при применении его в паре с другими лекарствами (RAP, RIF и PSORA). Тем не менее, продолжительность жизни нематод при применении комбинации из трех препаратов была хуже, чем при использовании любой двойной комбинации лекарств (Дополнительная схема 3а, вспомогательная таблица S2). Затем мы проверили эффективность тройной комбинации препаратов, в составе которой было лекарство ALLAN с уникальным профилем задействованных генов (светло-оранжевая дуга, схема 2а).
Профиль активности генов ALLAN не совпадал с профилем действующих генов других лекарств. Также он отличался от спектра мутантного траскриптома eat-2. Таким образом, мы предположили, что у соединения ALLAN есть уникальный механизм действия и, поэтому добавили его к тем двум парам комбинаций, которые показали синергический эффект. В обоих случаях наблюдалось статистически достоверное увеличение средней продолжительности жизни и ее максимума (Схема 2f,g, дополнительная схема 3d-f и вспомогательная таблица s2). Наилучшим по результатам стало сочетание из трех лекарств: RAP, RIF и ALLAN, благодаря которому у червей в два раза повысилось среднее время жизни, а медиана и максимум достигли 44 и 50 дней, соответственно (Вспомогательная таблица s2). Полученный эффект был сопоставим с эффектом от мутационных нарушений. По нашим сведениям, данное удлинение продолжительности жизни C.elegans оказалось самым большим, которое когда-либо было опубликовано в научной литературе при использовании, лекарств, примененных у взрослых особей.
Daf-16/FOXO является транскрипционным фактором, который играет ключевую роль в регуляции продолжительности жизни модельных организмов, а также, вероятно, человека. Для того, чтобы изучить механизм синергического действия, выявленных нами комбинаций препаратов, мы определили их эффективность, когда у червей имелась негативная по Daf-16 сигнальному пути мутация. Эффект таких препаратов как RAP или ALLAN, примененных по отдельности не зависел от сигнального пути Daf-16. По сравнению с ними удлинение продолжительности жизни с помощью RIF, полностью было обусловлено работой Daf-16 пути, а PSORA частично (Схема 3а, дополнительная схема 8).
Синергическая комбинация препаратов RAP+RIF включала один препарат RIF, действие которого всецело зависело от работы Daf-16 пути, и другой препарат RAP с эффектом независимым от этого сигнального пути. При сочетанном использовании препаратов RIF+PSORA также регистрировался синергетический эффект, несмотря на то, что активность препаратов была связана с функционированием Daf-16 пути, а у нематоды имелся мутантный ген Daf-16 (Схема 3а, дополнительная схема 8).
Такие результаты стали неожиданными, поскольку оказалось, что синергетический эффект обусловлен не только работой Daf-16 пути: данного эффекта удалось достигнуть у мутантных по гену Daf-16 червей с помощью препаратов, чьи действия полностью или частично зависели от функционирования этого гена.

Рис.3
По данным различных авторов, несколько тестируемых нами препаратов, являлись миметиками CR (Caloric restriction) т.е. лекарственными веществами, похожими на естественно синтезированные в организме соединения, отвечающими за снижение аппетита. Мы использовали eat-2 –мутантные модели C.elegans, чтобы выяснить влияют ли комбинации препаратов и их лекарства, характеризующиеся синергизмом действия, на CR-сигнальные пути. Только RIF соединение продлевало жизнь eat-2 мутантным нематодам. Следовательно, все остальные кроме RIF препараты относились к CR миметикам.
Таким образом, в двух комбинациях препаратов, RAP+RIF и RIF+PSORA, одно соединение относилось к CR миметикам, а эффект другого не зависел от мутации eat-2. Совместное применение RIF и PSORA привело к удлинению продолжительности жизни нематод, тогда как добавление ALLAN к этой комбинации препаратов не имело никакого эффекта на увеличение времени жизни червей. Мы полагаем, что такая закономерность обусловлена тем, что в данной комбинации препаратов ALLAN был вторым CR миметиком.
С целью дальнейшего исследования механизма лекарственной синергии, мы сделали транскриптомный профиль комбинаций препаратов с выявленным синергическим эффектом и комбинацией препаратов без такового эффекта. Нематодам давали один, два или три лекарственных соединения, чтобы выявить наличие или отсутствие данного эффекта. Транскриптом отдельных препаратов, отнесенных к CR – миметикам, кластеризовался в той же области, что и транскриптомный профиль eat-2 мутантных организмов. Напротив, соединение RIF не обладало CR – миметической активностью и его транскриптом отличался от результатов транскрипционного анализа eat-2 мутантов и других лекарственных веществ (Схема 2h).
Интересно отметить, что транскриптомы комбинаций препаратов с синергическим эффектом кластеризировались вместе и патерны их генных экспрессий отличались как от экспрессий отдельных входящих в комбинации лекарств, так и от eat-2 мутантов (Схема 2h, дополнительная схема 4 c, d). По сравнению с контрольной группой, при применении двойных и тройных синергических комбинаций препаратов часто был представлен TFGβ-сигнальный путь (Схема 4a, дополнительная схема 6с, 7a, вспомогательная таблица s4). Кроме того, мы сопоставили транскриптом комбинации препаратов с транскриптомом, входящих в нее лекарственных соединений, последние в данном случае служили в качестве контрольной группы (см. методы). В отличие от контрольной группы, комбинации препаратов с синергическим эффектом усиливали активность TGFβ и еще нескольких других сигнальных путей. У комбинаций препаратов без синергического действия такие пути не были представлены в транскрипионном профиле (Вспомогательная таблица s5).
Некоторые комбинации препаратов продлевали жизнь eat-2 мутантным нематодам, а отдельные лекарства в составе этих комбинаций нет. Мы решили проверить, будет ли у eat-2 мутантов после действия синергических комбинаций усилена активность TGFβ пути в отличие от eat-2 червей без лекарственной терапии. Единственным сигнальным путем, который был заметно представлен в транскриптоме после применения любой из синергических комбинаций препаратов, являлся TGFβ –путь (Дополнительная схема 7b, вспомогательная таблица S6). Для нас было полной неожиданностью, что данный путь исключительно определялся при воздействии синергических комбинаций лекарственных соединений (Схема 4b, дополнительная схема 7a,c, вспомогательная таблица s7).






Рис.4
Активация TGFβ-сигнального пути, выявленная в нашем исследовании, может быть основным механизмом, с помощью которого реализуется синергический эффект, увеличивающий срок жизни модельным организмам. Ранее в исследованиях было отмечено, что мутация TGF (daf-7) приводила к удлинению времени жизни через инсулиновый сигнальный путь. Также оба медиатора daf-2 и daf-7, регулировали транскрипцию daf-16-зависимых генов (Дополнительная схема 7d). Нам стало интересно, возможно ли с помощью отобранных нами комбинаций лекарств, продлить жизнь daf-2-мутантам, при том, что продолжительность жизни животных благодаря этой мутации и так была выше. Для начала мы определили время жизни daf-2 мутированных нематод после действия каждой комбинации препаратов.
Прирост во времени жизни был зарегистрирован в RAP-содержащих комбинациях: RAP+RIF и RAP+RIF+ALLAN. Однако величина прироста оказалась почти такой же, как при применении только RAP препарата. Синергический эффект, удлиняющий жизнь нематод, не наблюдался ни у одной комбинации препаратов (Схема 3с, дополнительная схема 8, вспомогательная таблица s2). Действие PSORA также способствовало увеличению времени жизни daf-2-мутантных червей, но сочетание лекарств, включающих этот препарат (RIF+PSORA и RIF+PSORA+ALLAN) имело нейтральный эффект на долголетие нематод (Схема 3с и дополнительная схема 8).
В дальнейшем мы протестировали эффективность всех синергических комбинаций препаратов и лекарственных веществ, из которых они состояли, на daf-7 мутантах. Ни в одном случае синергический эффект не был выявлен. Мы пришли к выводу, что лекарственный синергизм обусловлен работой daf-7 сигнального пути, даже, несмотря на то, что при этих условиях отдельные лекарства из комбинации эффективны в плане увеличения продолжительности жизни (Схема 3d, дополнительная схема 8).
Как сообщалось ранее в исследованиях, у долгоживущих мутантных по age-1 и daf-2 линиях нематод происходят метаболические перестройки, в результате которых усиливается производство и накопление жира. Кроме того, TGFβ/daf-7 путь регулирует метаболизм триацилглицерола (TAG) и, известно, что мутантные по daf-7 нематоды запасают больше жира. Эти сведения и данные нашей работы заставили нас изучить, влияют ли комбинации препаратов, характеризующиеся синергизмом, на липидный профиль нематод, с заблокированным TGFβ сигнальным путем (Вспомогательная таблица s3).
На начальном этапе мы сделали транскриптомный анализ наших результатов, с целью найти сигнальные пути, изменяющих липидный состав, и обнаружили, что сочетания лекарств с синергическим эффектом повышают у C.elegans уровень гомолога SREBP-1c: sbp-1. Он служит основным транскрипционным фактором, контролирующим гены, отвечающих за синтез различных липидов и ферментов-десатураз. Последние участвуют в образовании мононенасыщенных жирных кислот (MUFA) (Схема 4с, е). В дальнейшем, мы выполнили анализ липидома методом масс-спектрометрии, чтобы выявить изменения в липидном профиле после воздействия лекарственными препаратами. У нематод после применения синергических комбинаций препаратов, значительно увеличивались запасы TAG, соотношение MUFA:PUFA (мононенасыщенных жирных кислот к полиненасыщенным) и количество 16:1 и 19:1 мононенасыщенных жирных кислот (MUFAs)(Схема 4f).
Вследствие этого, наблюдалось снижение индекса двойной связи(DBI)(показывает степень ненасыщенности жирных кислот) и индекса перекисного окисления липидов (PI) (Схема 4i). Низкий PI указывает на то, что липиды содержат меньшее количество двойных связей между углеродами, тем самым способность липидов к реакции перекисного окисления падает. Согласно результатам различных авторов, снижение способности к перекисному окислению было ассоциировано с увеличением продолжительности жизни, возможно, потому что липиды были менее подвержены процессу окисления в организме.
Считается, что при подавлении процесса перекисного окисления улучшается устойчивость к окислительному стрессу. В нашей работе, у червей после применения синергических комбинаций препаратов, действительно, повышалась такая устойчивость (Схема 5 e,f). Более того, мы отметили возрастание общего уровня сфингомиелина у нематод (Схема 4h). Учеными было показано, что этот показатель вызывал увеличение срока жизни червей посредством усиления аутофагии.

Рис.5
К удлинению жизни C. elegans может привести подавление энергетического метаболизма и блокирование работы мембранной цепи транспорта электронов (ETC). Данный факт не объясняет, результатов в нашем исследовании, так как у нематод не удалось выявить заметного уменьшения скорости основного обмена (Схема 5i). В научной литературе описано, что чаще всего долголетию сопутствовали такие факторы, как: замедление роста и развития, а также снижение плодовитости. Мы не нашли, что у червей, которым давали разные синергические комбинации препаратов, существенно менялась продолжительность взрослого периода жизни и общая фертильность. Хотя после добавления этих комбинаций, было зарегистрировано небольшое увеличение репродуктивного периода у нематод (Схема 5а-с, дополнительная схема 9а).
На следующем этапе, определялись: показатели адаптации, уровень переносимости стрессовых ситуаций и жизнеспособность нематод. Мы оценили скорость самопроизвольного движения, резистентность к тепловому шоку, устойчивость к окислительному стрессу, а также вычислили жизнеспособность червей по шкале спонтанной подвижности, рассчитанной по методу Хердона (Herndon). В контрольной группе период активной жизни составлял примерно 50% от всей продолжительности жизни нематод. Аналогичный показатель у червей, получивших препараты RIF+PSORA+ALLAN или RAP+RIF+ALLAN, достиг соответственно 57% и 63% от времени их увеличенной жизни (Схема 5d, дополнительные данные 9с). Таким образом, значительно возрастали как абсолютное время жизни, так и относительный период активной деятельности нематод.
Мы наблюдали, что когда в контрольной группе погибал последний червь, в другой – у более половины особей отмечался оптимальный уровень жизнедеятельности (Схема 5d, дополнительные данные 9с). Анализ самопроизвольных движений показал, что в экспериментальной группе вне зависимости от возраста червей, их подвижность после действия таких комбинаций препаратов, как: RIF+PSORA+ALLAN или RAP+RIF+ALLAN, была заметно выше, чем у нематод в контрольной группе. Действительно, спонтанная подвижность старых особей (18 день жизни), у которых применялись лекарственные препараты, ничем не отличалась от двигательной активности молодых червей (7 день жизни) в контрольной группе (Схема 5g). Кроме того, лекарственная терапия червей повышала их устойчивость к тепловому и окислительному стрессу (токсикологический анализ, схема 5e,f, дополнительная схема 9b). Наши наблюдения указывают на то, что у нематод после действия синергических комбинаций препаратов удлинялся период активной жизни, повышалась устойчивость к стрессовым факторам и, даже, подвижность особей, при этом компенсаторные изменения в их физиологическом развитии отсутствовали или были минимальны.
Учитывая данные результаты, мы сомневаемся, что увеличение продолжительности жизни происходит вследствие замедления скорости биологического старения. Скорость старения может быть выражена показателем времени, за которое в два раза повышается смертность особей (MRDT или время удвоения интенсивности смертности). Используя аналитическую платформу Survcurv, мы определили этот параметр у модельных организмов после применения синергических комбинаций препаратов. При сочетанном действии препаратов RIF+PSORA+ALLAN уровень MRDT нематод был существенно больше, чем такой же показатель в контрольной группе(MRDT=3,7 и 3 дня, Р<0,0001, соответственно).
Уровень смертности молодых червей (IMR) в экспериментальной группе также оказался заметно ниже (IMR контрольной группы = 2.7e-3, IMR при действии RIF+PSORA+ALLAN = 8.5e-4, RAP+RIF+ALLAN = 9.3e-4, P< 0,001). Мы пришли к выводу, что благодаря применению синергических комбинаций лекарственных препаратов, замедлялся процесс старения нематод и повышалась устойчивость к различным негативным факторам у молодых особей, что в итоге привело к продлению их жизни.
Одним из ключевых вопросов исследований процесса старения является вопрос переноса достигнутого результата по продлению жизни с одного на другие виды организмов. По этой причине мы изучили, будет ли эффект лекарственного синергизма, удлиняющий жизнь C.elegans, сохраняться в экспериментах на Drosophila melanogaster. Ранее в исследованиях учеными было показано, что RAP увеличивал срок жизни плодовых мушек, в то время как MET был не эффективен. Мы последовательно оценили действие отдельных препаратов и их комбинаций на время жизни самцов плодовых мушек. Вначале, мы продемонстрировали, что лекарственные соединения RAP и ALLAN удлиняли средний срок жизни плодовых мушек, тогда как RIF и PSORA повышали только максимальные показатели продолжительности жизни организмов (Схема 6, вспомогательная таблица s2).
Синергический эффект, продлевающий период жизни мушек, был выявлен у комбинаций препаратов на основе соединения RAP: RAP+RIF и RAP+RIF+ALLAN (Схема 6а). Мы не обнаружили прироста в среднем времени жизни мушек при применении комбинаций препаратов, содержащих PSORA: RIF+PSORA и RIF+PSORA+ALLAN (Схема 6b). Однако, по сравнению с результатами действия отдельных препаратов сочетание лекарств RIF+PSORA привело к синергическому эффекту, увеличивающему максимальную продолжительность жизни организмов (Схема 6с). Поскольку у плодовой мушки Drosophila melanogaster сохранялся эффект лекарственной синергии, мы считаем, что результаты нашей работы подтверждают существование эволюционно-консервативного механизма, который, обуславливает функционирование данного синергического эффекта.

Рис.6
В настоящей работе нам удалось найти несколько комбинаций препаратов с синергическим действием. Они избирательно влияли на определенные сигнальные пути, ассоциированные со старением и долголетием. Кроме того, сигнальные пути могли пересекаться между собой. Даже при том условии, что такие комбинации препаратов применялись только во взрослом возрасте, продолжительность активной жизни C.elegans повышалась в два раза. Размер эффекта от лекарственных вмешательств, был сравним с эффектом после классических мутаций, замедляющих старение. Насколько нам известно, это исследование стало самым масштабным по количеству и объему лекарственных вмешательств у взрослых животных.
При использовании синергических лекарственных комбинаций, увеличивающих продолжительность жизни червей, мы не смогли обнаружить каких-либо сопутствующих отрицательных компенсаторных нарушений или нарушений в развитии животного. Подобные нарушения наблюдались у организмов с мутациями в генах, связанных со старением. Также отмеченный позитивный лекарственный эффект был не за счет снижения работы мембранной цепи транспорта электронов (ETC) или подавления метаболизма у червей. Оценка данных показателей проводилась на основании уровня потребления кислорода.
Действительно, животные, получившие лекарственные комбинации препаратов, превосходили контрольную группу организмов по показателям двигательной активности. Физическая форма и активность у старых особей в экспериментальной группе и у более молодых в контрольной группе была одинаковой (Схема 5g). Анализ смертности, показал, что синергическое действие комбинаций препаратов замедляет скорость биологического старения примерно на 20% (Дополнительная схема 10). Чтобы проверить положительный эффект лекарственного синергизма и его эволюционный консерватизм, мы выполнили несколько экспериментов на плодовой мушке Drosophila melanogaster. У двух из четырех комбинаций препаратов подтвердилась сохранность синергического действия.
Эволюционно нематоды более близки к млекопитающим, чем к мухам. Следовательно, такие консервативные механизмы и сигнальные пути у плодовых мушек и нематод являются древними. Вероятно, изначально механизм синергического действия существовал у общего для данных трех классов животных предка.
Для того чтобы изучить механизм действия лекарственной синергии, продляющей жизнь червям, мы провели несколько эпистазных экспериментов (Эпистаз-подавление действия аллельной пары генов геном не аллельной пары) и транскриптомный анализ. В результате нам удалось найти, что сигнальные пути daf-2/daf-16 (IGF/FOXO) и TGF (daf-7), играют важную роль в функционировании синергического эффекта (Схема 4j). Связь между этими двумя путями была подтверждена также в других исследованиях. Их авторы сообщают, что daf-7 регулировал продолжительность жизни животных через инсулиновый сигнальный путь, а нейронный TGF путь был ассоциирован с приемом пищевых веществ и долголетием. Кроме того, daf-7 контролировал метаболизм C. elegans и процесс запасания жира. Мутации, удлиняющие жизнь C. elegans, действовали на липидный обмен червей через повышение количества мононенасыщенных липидов и снижение количества полиненасыщенных липидов.
Данные результаты согласуются с выводами, полученными в нашем исследовании. Лекарственная синергия повышала уровень главного транскрипционного фактора sbp-1, влияющего на липидный метаболизм и синтез мононенасыщенных липидов (Схема 4с, е, дополнительная схема 5). Масс-спектральный анализ липидома нематод, у которых применялись различные комбинации препаратов с синергическим эффектом, выявил изменения в жировом обмене: активацию sbp-1-фактора, накопление триацилглицерина и увеличение соотношения моно –и полиненасыщенных липидов в сторону увеличения первых (в т.ч. в двух классов липидов – фосфатидилхолиновом и фосфатидилэтаноламиновом). Наконец, в научной литературе описано, что преобладание мононенасыщенных липидов над полиненасыщенными, найдено в липидном профиле мембран эритроцитов детей, чьи родители дожили до 90 и более лет.
В мире существует огромный интерес у ученых к потенциальной способности препарата MET и, возможно, также соединения RAP, к замедлению развития возраст-зависимых нарушений и предотвращению заболеваний человека. Учитывая повышенное внимание к этому вопросу, мы хотим упомянуть об экспериментах, в которых эффективность комбинации препаратов MET и RAP у C. elegans и мышей, оказалась слабой. Такие результаты разочаровали многих ученых.
В нашей работе, мы продемонстрировали, что продолжительность жизни определялась комплексом сигнальных путей и взаимодействующих между собой генов и биохимических молекул. Одновременное влияние на несколько мишеней определенных сигнальных путей способно привести к заметному положительному эффекту и иногда непредсказуемому результату. В настоящем исследовании, основанном на принципе доказательности, мы применяли лекарственные препараты действующие на ключевые сигнальные пути.
Неожиданно нами был открыт синергический эффект, который имел универсальный и эволюционно-консервативный характер. Результаты нашей работы подтверждают обоснованность использования для замедления скорости биологического старения лекарственных препаратов, которые точечно меняют активность сразу множества консервативных сигнальных путей. Если ученым удастся перенести подобный принцип действия на людей, то это позволит значительно повысить эффективность медицинской помощи и экономическое благосостояние общества.
Перевод: Татьяна Гнетеева.
Насколько нам известно, продолжительность жизни нематод C.elegans, достигнутая на взрослых организмах с помощью лекарств была самой высокой в нашей работе. Мы применяли лекарственные препараты, изначально предназначенные для терапии разных заболеваний взрослых людей. Разработка метода, основанного на использовании уже одобренных препаратов, действующих одновременно на несколько сигнальных путей, связанных со старением, считается очень перспективной. Она может привести к предотвращению развития возраст-зависимых заболеваний и физической астении пожилого населения мира, которое стремительно стареет.
Введение
Одним из наиболее важных этапов в науке о старении стало открытие эволюционно-консервативных сигнальных путей, отвечающих за регуляцию продолжительности жизни организма. Мутации в генах, затрагивающих эти сигнальные пути, могут привести к удлинению продолжительности жизни от 30 до 100% у модельных организмов. Сочетанные генные мутации способны вызвать синергический эффект, увеличивающий срок жизни. Эффект от фармакологических вмешательств обычно намного слабее, чем от генетических мутаций, даже, если они действуют на одни и те же сигнальные пути.
Наличие синергического эффекта при нескольких сочетанных генных нарушениях наводит нас на мысль, что возможным перспективным направлением в будущем станет использование таких лекарственных препаратов, которые одновременно будут влиять на несколько эволюционно-консервативных сигнальных путей. На сегодняшний день зарегистрировано немного данных о синергическом эффекте при применении лекарственных препаратов, направленных на увеличение продолжительности жизни. В данной работе, мы сообщаем о результатах нового исследования выполненного в условиях in vivo, в котором использовались такие лекарственные препараты. Мы продемонстрировали, как комбинация из препаратов может максимально увеличить эффект терапии за счет того, что они действуют на несколько сигнальных путей, с взаимно усиливающим эффектом друг друга. При этом получилось снизить до минимума частоту побочных реакций и ¬уровень компенсаторных нарушений в развитии организма, поскольку осуществлялись точечные изменения в отдельных, но взаимодействующих между собой сигнальных путях. Конечной целью исследования была разработка схемы фармакологической терапии взрослого населения, с доказанным на процесс старения эффектом, которой равнялся эффекту от мутаций, или же превышал его.
Так как общепризнанных биологических маркеров старения немного, в настоящее время, для того, чтобы оценить результаты выполненного исследования, сравнивают просто общую продолжительность жизни организмов. В качестве короткоживущего модельного организма использовалась нематода вида Caenorhabditis elegans. Далее мы подобрали несколько комбинаций препаратов, таким образом, что были созданы 2 группы лекарств, в каждой из которых насчитывалось по три препарата. Как было ранее опубликовано в исследованиях, при применении этих комбинаций препаратов отмечалась значительная разница в увеличении продолжительности жизни и удлинении здоровой жизни нематод C.elegans.
Синергический эффект, полученный при действии комбинации препаратов, оказался сравним с тем, который наблюдался после направленных мутаций в общеизвестных генах, связанных со старением. Мы не выявили никаких компенсаторных нарушений в развитии организмов из тех, которые часто встречаются и ассоциированы с фармакологическим вмешательством. Нам удалось косвенно определить, что лекарственная терапия замедляла скорость естественного старения, поскольку уровень некоторых маркеров повышался. Кроме того, мы пришли к выводу, что TGFβ (Трансформирующий фактор роста β1) являлся ключевым фактором, обеспечивающим синергический эффект сигнального пути. Дополнительно, в исследовании было показано, что у нематод, пролеченных вышеуказанными комбинациями препаратов, соотношение мононенасыщенных липидов к полиненасыщенным изменилось сторону преобладания первых (возрастание соотношения MUFA к PUFA), а уровень перекисного окисления мембранных липидов снизился. Наконец, мы подтвердили, что подобный синергический эффект определялся также и у плодовых мушек вида Drosophila melanogaster.
Результаты
Выбор сигнальных путей и мишеней в C. Elegans.
На основе современной научной литературы, мы нашли несколько эволюционно-консервативных сигнальных путей и механизмов, связанных со старением (Вспомогательный материал, таблица S1). Среди выбранных нами мишеней и механизмов были: АМФ-активируемая протеинкиназа, c-Jun-N-терминальная киназа (JNK), мишень рапамицина млекопитающих (mTOR) и механизмы, задействованные в процессах: ограничения калорий (CR), митогомезиса (действие малых доз веществ, которые в больших дозах являются токсичными) и митохондриального метаболизма. Вышеописанные мишени и процессы считаются основными в регуляции сигнальных путей продлевающих жизнь. Для каждого сигнального пути были определены лекарственные препараты, влияние которых на долголетие описано, по крайней мере, у одного из известных модельных организмов (нематод, плодовых мушек или мышей).
Препараты, проверенные на людях, представляли особый интерес для нас. Поэтому мы отдали предпочтение лекарственным соединениям с заявленной эффективностью у млекопитающих или одобренных у человека. Первоначально мы нашли 11 потенциальных препаратов соответствующих вышеописанным критериям (Вспомогательная таблица S1). Мы добавили в наш список аллантоин на основе отчета о его способности продлевать жизнь у C.elegans и результатов транскрипционного анализа. У нас есть подозрения, что механизм его действия отличается от остальных веществ. Чтобы избежать ошибок в измерении продолжительности жизни организмов после применения препаратов, сначала мы тестировали слепым методом исполнителя работ. Основной причиной для этого послужил тот факт, что результаты исследования могут сильно зависеть от правильности условий эксперимента и значительно отличаться среди разных лабораторий. Мы использовали только те дозы препаратов, которые ранее были описаны в научных работах. Эффективность пяти препаратов, влияющих на продолжительность жизни, неоднократно была подтверждена в условиях нашей лаборатории (рис.1, вспомогательная таблица S2). Как правило, �� нашем исследовании эффективность соединений, ассоциированных с увеличением жизни организмов, была несколько меньше, чем в опубликованных прежде работах (Дополнительная схема 1, вспомогательная таблица S2).

Рис. 1
Транскриптом, лекарственные препараты и долголетие
Чтобы оценить эффективность действия препаратов в исследовании, мы выполнили транскриптомный анализ и определи дифференционально экспрессированные гены (DEG) и провели обогащение сигнальных путей по отношению к контролю. Мы заметили определенные отличия в экспрессии генов и активности сигнальных путей в экспериментальной группе, которых не было в контрольной группе. Наиболее существенные изменения в экспрессии генов и работе сигнальных путей были вызваны действием одной комбинации препаратов, состоящей из рифампицина, рапамицина и psora-4 (PSORA), где последний препарат вводился после первых двух. В отличие от упомянутых препаратов, метформин (MET) и аллантоин (ALLAN) влиял на экспрессию меньшего количества генов (Схема 2а, вспомогательная таблица S3).
Анализ транскрипционных результатов показал, что каждое лекарственное вещество имело свой уникальный профиль измененных им генов. В тоже время часть этих генов также была обнаружена в транскрипционных профилях остальных препаратов (Схема 2а). Так, MET действовал на работу многих «популярных» генов, но количество, вовлеченных уникальных генов у него было минимальным. Препараты МЕТ и PSORA меняли активность почти всего спектра «популярных» генов, на часть из которых также по отдельности влияли препараты, приведенные в Схеме 2а.
Соединение ALLAN затрагивало наименьшее число генов, зато большая часть из них принадлежала к уникальной группе. Менее половины его генов было представлено в транскрипционном спектре других лекарственных препаратов. Эффект от применения RIF и RAP значительно отличался друг от друга и от любых других лекарств. Основываясь на трех критериях метода главных компонент (PCA), мы пришли выводу, что RIF, RAP и PSORA были очень обособлены от остальных препаратов. Напротив, эффекты от воздействия ALLAN и MET являлись более вариабельными, но очень схожими между собой. Кроме того, их результаты были несколько приближенными к результатам контрольной группы.





Рис.2
На следующем этапе, мы определили, как влияют различные лекарственные комбинации на время жизни нематод. Поскольку действия MET и RAP легче перенести на человека, эти препараты нами были изучены в первую очередь. Однако, оказалось, что комбинация MET и RAP в оптимальных дозах 50мг и 100мг, не привела к еще большему удлинению продолжительности жизни (Дополнительная схема 2 J,P). Мы выполнили еще несколько исследований с использованием всех возможных комбинаций этих препаратов в оптимальных и полуоптимальных дозах (Дополнительная схема 2 J-P).
Результатом применения MET и RAP в их полуоптимальных дозах стало увеличение максимума срока жизни нематод (Схема 2е, Дополнительная схема 2 m,s), но не среднего значения продолжительности жизни (Дополнительная схема, 2p). Это незначительное преимущество MET и RAP согласуется с выводами другого исследования на мышах. В нем доказано, что добавление MET к RAP главным образом продляло жизнь самцам, а у самок результат был малозаметным (когда он вообще регистрировался).
Далее мы последовательно выяснили эффекты 10-ти комбинаций лекарств. В каждой комбинации лекарств было два препарата из пяти возможных (Дополнительная схема 2 a-i). Анализ синергического эффекта осуществлялся с помощью HSA- модели (Higher Single Activity model), оценивающей степень активности одного из двух лекарств.
Результат от сочетанного применения различных лекарств, считался, как синергический, при условии, что он сильно превышал результат, полученный от действия каждого препарата по отдельности и тогда, когда дозы лекарств были одинаковыми. Учитывая вышеупомянутое определение, мы установили, что только у двух из десяти комбинаций лекарств наблюдался синергический эффект (схема 2c, d, дополнительная схема 2 и вспомогательная таблица S2), зафиксированный при сочетании препаратов: RIF с RAP и RIF c PSORA. С данными препаратами можно было составить три различные лекарственные комбинации, но только две из них больше всего отличались друг от друга по результатам PCA-анализа. Именно у последних двух был выявлен синергический эффект (Схема 2b, дополнительная схема 4a,b).
Среди оставшихся 8 пар лекарственных препаратов, эффект на продолжительность жизни у 4-х был таким же, как у наиболее эффективного препарата в соответствующей лекарственной комбинации. В 4-х других комбинациях эффект одного лекарства взаимно исключал действие другого. В последнем случае, также отмечалось отсутствие токсических реакций и увеличения срока жизни (Дополнительная схема 2, вспомогательная таблица S2).
В нашем исследовании использование двух комбинаций лекарственных препаратов с синергическим эффектом привело к более значительному удлинению жизни, по сравнению с данными, опубликованными ранее в научной литературе. Однако, прирост продолжительности жизни после лекарственного применения оказался меньше, чем подобный эффект от мутационных нарушений. В связи с этим у нас возникли вопросы: являются ли настоящие показатели выживаемости максимумом, которого можно достичь при лекарственном лечении взрослых животных? Получим ли мы дополнительное увеличение периода жизни за счет добавления других соединений? Если комбинация препаратов будет включать три лекарственных соединения, тогда число возможных сочетаний возрастает до 30. У нас не было возможности проверить такое количество комбинаций препаратов.
Поэтому мы выборочно изучили действие некоторых тройных комбинаций препаратов. В первую очередь нами была рассмотрена комбинация препаратов, в которой все три лекарственных соединения больше всего отличались между собой на основании критериев PCA-метода. Еще одним условием являлось наличие у препарата синергического эффекта при применении его в паре с другими лекарствами (RAP, RIF и PSORA). Тем не менее, продолжительность жизни нематод при применении комбинации из трех препаратов была хуже, чем при использовании любой двойной комбинации лекарств (Дополнительная схема 3а, вспомогательная таблица S2). Затем мы проверили эффективность тройной комбинации препаратов, в составе которой было лекарство ALLAN с уникальным профилем задействованных генов (светло-оранжевая дуга, схема 2а).
Профиль активности генов ALLAN не совпадал с профилем действующих генов других лекарств. Также он отличался от спектра мутантного траскриптома eat-2. Таким образом, мы предположили, что у соединения ALLAN есть уникальный механизм действия и, поэтому добавили его к тем двум парам комбинаций, которые показали синергический эффект. В обоих случаях наблюдалось статистически достоверное увеличение средней продолжительности жизни и ее максимума (Схема 2f,g, дополнительная схема 3d-f и вспомогательная таблица s2). Наилучшим по результатам стало сочетание из трех лекарств: RAP, RIF и ALLAN, благодаря которому у червей в два раза повысилось среднее время жизни, а медиана и максимум достигли 44 и 50 дней, соответственно (Вспомогательная таблица s2). Полученный эффект был сопоставим с эффектом от мутационных нарушений. По нашим сведениям, данное удлинение продолжительности жизни C.elegans оказалось самым большим, которое когда-либо было опубликовано в научной литературе при использовании, лекарств, примененных у взрослых особей.
Механизм лекарственной синергии
Daf-16/FOXO является транскрипционным фактором, который играет ключевую роль в регуляции продолжительности жизни модельных организмов, а также, вероятно, человека. Для того, чтобы изучить механизм синергического действия, выявленных нами комбинаций препаратов, мы определили их эффективность, когда у червей имелась негативная по Daf-16 сигнальному пути мутация. Эффект таких препаратов как RAP или ALLAN, примененных по отдельности не зависел от сигнального пути Daf-16. По сравнению с ними удлинение продолжительности жизни с помощью RIF, полностью было обусловлено работой Daf-16 пути, а PSORA частично (Схема 3а, дополнительная схема 8).
Синергическая комбинация препаратов RAP+RIF включала один препарат RIF, действие которого всецело зависело от работы Daf-16 пути, и другой препарат RAP с эффектом независимым от этого сигнального пути. При сочетанном использовании препаратов RIF+PSORA также регистрировался синергетический эффект, несмотря на то, что активность препаратов была связана с функционированием Daf-16 пути, а у нематоды имелся мутантный ген Daf-16 (Схема 3а, дополнительная схема 8).
Такие результаты стали неожиданными, поскольку оказалось, что синергетический эффект обусловлен не только работой Daf-16 пути: данного эффекта удалось достигнуть у мутантных по гену Daf-16 червей с помощью препаратов, чьи действия полностью или частично зависели от функционирования этого гена.

Рис.3
По данным различных авторов, несколько тестируемых нами препаратов, являлись миметиками CR (Caloric restriction) т.е. лекарственными веществами, похожими на естественно синтезированные в организме соединения, отвечающими за снижение аппетита. Мы использовали eat-2 –мутантные модели C.elegans, чтобы выяснить влияют ли комбинации препаратов и их лекарства, характеризующиеся синергизмом действия, на CR-сигнальные пути. Только RIF соединение продлевало жизнь eat-2 мутантным нематодам. Следовательно, все остальные кроме RIF препараты относились к CR миметикам.
Таким образом, в двух комбинациях препаратов, RAP+RIF и RIF+PSORA, одно соединение относилось к CR миметикам, а эффект другого не зависел от мутации eat-2. Совместное применение RIF и PSORA привело к удлинению продолжительности жизни нематод, тогда как добавление ALLAN к этой комбинации препаратов не имело никакого эффекта на увеличение времени жизни червей. Мы полагаем, что такая закономерность обусловлена тем, что в данной комбинации препаратов ALLAN был вторым CR миметиком.
С целью дальнейшего исследования механизма лекарственной синергии, мы сделали транскриптомный профиль комбинаций препаратов с выявленным синергическим эффектом и комбинацией препаратов без такового эффекта. Нематодам давали один, два или три лекарственных соединения, чтобы выявить наличие или отсутствие данного эффекта. Транскриптом отдельных препаратов, отнесенных к CR – миметикам, кластеризовался в той же области, что и транскриптомный профиль eat-2 мутантных организмов. Напротив, соединение RIF не обладало CR – миметической активностью и его транскриптом отличался от результатов транскрипционного анализа eat-2 мутантов и других лекарственных веществ (Схема 2h).
Интересно отметить, что транскриптомы комбинаций препаратов с синергическим эффектом кластеризировались вместе и патерны их генных экспрессий отличались как от экспрессий отдельных входящих в комбинации лекарств, так и от eat-2 мутантов (Схема 2h, дополнительная схема 4 c, d). По сравнению с контрольной группой, при применении двойных и тройных синергических комбинаций препаратов часто был представлен TFGβ-сигнальный путь (Схема 4a, дополнительная схема 6с, 7a, вспомогательная таблица s4). Кроме того, мы сопоставили транскриптом комбинации препаратов с транскриптомом, входящих в нее лекарственных соединений, последние в данном случае служили в качестве контрольной группы (см. методы). В отличие от контрольной группы, комбинации препаратов с синергическим эффектом усиливали активность TGFβ и еще нескольких других сигнальных путей. У комбинаций препаратов без синергического действия такие пути не были представлены в транскрипионном профиле (Вспомогательная таблица s5).
Некоторые комбинации препаратов продлевали жизнь eat-2 мутантным нематодам, а отдельные лекарства в составе этих комбинаций нет. Мы решили проверить, будет ли у eat-2 мутантов после действия синергических комбинаций усилена активность TGFβ пути в отличие от eat-2 червей без лекарственной терапии. Единственным сигнальным путем, который был заметно представлен в транскриптоме после применения любой из синергических комбинаций препаратов, являлся TGFβ –путь (Дополнительная схема 7b, вспомогательная таблица S6). Для нас было полной неожиданностью, что данный путь исключительно определялся при воздействии синергических комбинаций лекарственных соединений (Схема 4b, дополнительная схема 7a,c, вспомогательная таблица s7).






Рис.4
Значение TGFβ сигнального пути для лекарственной синергии
Активация TGFβ-сигнального пути, выявленная в нашем исследовании, может быть основным механизмом, с помощью которого реализуется синергический эффект, увеличивающий срок жизни модельным организмам. Ранее в исследованиях было отмечено, что мутация TGF (daf-7) приводила к удлинению времени жизни через инсулиновый сигнальный путь. Также оба медиатора daf-2 и daf-7, регулировали транскрипцию daf-16-зависимых генов (Дополнительная схема 7d). Нам стало интересно, возможно ли с помощью отобранных нами комбинаций лекарств, продлить жизнь daf-2-мутантам, при том, что продолжительность жизни животных благодаря этой мутации и так была выше. Для начала мы определили время жизни daf-2 мутированных нематод после действия каждой комбинации препаратов.
Прирост во времени жизни был зарегистрирован в RAP-содержащих комбинациях: RAP+RIF и RAP+RIF+ALLAN. Однако величина прироста оказалась почти такой же, как при применении только RAP препарата. Синергический эффект, удлиняющий жизнь нематод, не наблюдался ни у одной комбинации препаратов (Схема 3с, дополнительная схема 8, вспомогательная таблица s2). Действие PSORA также способствовало увеличению времени жизни daf-2-мутантных червей, но сочетание лекарств, включающих этот препарат (RIF+PSORA и RIF+PSORA+ALLAN) имело нейтральный эффект на долголетие нематод (Схема 3с и дополнительная схема 8).
В дальнейшем мы протестировали эффективность всех синергических комбинаций препаратов и лекарственных веществ, из которых они состояли, на daf-7 мутантах. Ни в одном случае синергический эффект не был выявлен. Мы пришли к выводу, что лекарственный синергизм обусловлен работой daf-7 сигнального пути, даже, несмотря на то, что при этих условиях отдельные лекарства из комбинации эффективны в плане увеличения продолжительности жизни (Схема 3d, дополнительная схема 8).
Лекарственная синергия, MUFA и продолжительность жизни
Как сообщалось ранее в исследованиях, у долгоживущих мутантных по age-1 и daf-2 линиях нематод происходят метаболические перестройки, в результате которых усиливается производство и накопление жира. Кроме того, TGFβ/daf-7 путь регулирует метаболизм триацилглицерола (TAG) и, известно, что мутантные по daf-7 нематоды запасают больше жира. Эти сведения и данные нашей работы заставили нас изучить, влияют ли комбинации препаратов, характеризующиеся синергизмом, на липидный профиль нематод, с заблокированным TGFβ сигнальным путем (Вспомогательная таблица s3).
На начальном этапе мы сделали транскриптомный анализ наших результатов, с целью найти сигнальные пути, изменяющих липидный состав, и обнаружили, что сочетания лекарств с синергическим эффектом повышают у C.elegans уровень гомолога SREBP-1c: sbp-1. Он служит основным транскрипционным фактором, контролирующим гены, отвечающих за синтез различных липидов и ферментов-десатураз. Последние участвуют в образовании мононенасыщенных жирных кислот (MUFA) (Схема 4с, е). В дальнейшем, мы выполнили анализ липидома методом масс-спектрометрии, чтобы выявить изменения в липидном профиле после воздействия лекарственными препаратами. У нематод после применения синергических комбинаций препаратов, значительно увеличивались запасы TAG, соотношение MUFA:PUFA (мононенасыщенных жирных кислот к полиненасыщенным) и количество 16:1 и 19:1 мононенасыщенных жирных кислот (MUFAs)(Схема 4f).
Вследствие этого, наблюдалось снижение индекса двойной связи(DBI)(показывает степень ненасыщенности жирных кислот) и индекса перекисного окисления липидов (PI) (Схема 4i). Низкий PI указывает на то, что липиды содержат меньшее количество двойных связей между углеродами, тем самым способность липидов к реакции перекисного окисления падает. Согласно результатам различных авторов, снижение способности к перекисному окислению было ассоциировано с увеличением продолжительности жизни, возможно, потому что липиды были менее подвержены процессу окисления в организме.
Считается, что при подавлении процесса перекисного окисления улучшается устойчивость к окислительному стрессу. В нашей работе, у червей после применения синергических комбинаций препаратов, действительно, повышалась такая устойчивость (Схема 5 e,f). Более того, мы отметили возрастание общего уровня сфингомиелина у нематод (Схема 4h). Учеными было показано, что этот показатель вызывал увеличение срока жизни червей посредством усиления аутофагии.

Рис.5
К удлинению жизни C. elegans может привести подавление энергетического метаболизма и блокирование работы мембранной цепи транспорта электронов (ETC). Данный факт не объясняет, результатов в нашем исследовании, так как у нематод не удалось выявить заметного уменьшения скорости основного обмена (Схема 5i). В научной литературе описано, что чаще всего долголетию сопутствовали такие факторы, как: замедление роста и развития, а также снижение плодовитости. Мы не нашли, что у червей, которым давали разные синергические комбинации препаратов, существенно менялась продолжительность взрослого периода жизни и общая фертильность. Хотя после добавления этих комбинаций, было зарегистрировано небольшое увеличение репродуктивного периода у нематод (Схема 5а-с, дополнительная схема 9а).
На следующем этапе, определялись: показатели адаптации, уровень переносимости стрессовых ситуаций и жизнеспособность нематод. Мы оценили скорость самопроизвольного движения, резистентность к тепловому шоку, устойчивость к окислительному стрессу, а также вычислили жизнеспособность червей по шкале спонтанной подвижности, рассчитанной по методу Хердона (Herndon). В контрольной группе период активной жизни составлял примерно 50% от всей продолжительности жизни нематод. Аналогичный показатель у червей, получивших препараты RIF+PSORA+ALLAN или RAP+RIF+ALLAN, достиг соответственно 57% и 63% от времени их увеличенной жизни (Схема 5d, дополнительные данные 9с). Таким образом, значительно возрастали как абсолютное время жизни, так и относительный период активной деятельности нематод.
Мы наблюдали, что когда в контрольной группе погибал последний червь, в другой – у более половины особей отмечался оптимальный уровень жизнедеятельности (Схема 5d, дополнительные данные 9с). Анализ самопроизвольных движений показал, что в экспериментальной группе вне зависимости от возраста червей, их подвижность после действия таких комбинаций препаратов, как: RIF+PSORA+ALLAN или RAP+RIF+ALLAN, была заметно выше, чем у нематод в контрольной группе. Действительно, спонтанная подвижность старых особей (18 день жизни), у которых применялись лекарственные препараты, ничем не отличалась от двигательной активности молодых червей (7 день жизни) в контрольной группе (Схема 5g). Кроме того, лекарственная терапия червей повышала их устойчивость к тепловому и окислительному стрессу (токсикологический анализ, схема 5e,f, дополнительная схема 9b). Наши наблюдения указывают на то, что у нематод после действия синергических комбинаций препаратов удлинялся период активной жизни, повышалась устойчивость к стрессовым факторам и, даже, подвижность особей, при этом компенсаторные изменения в их физиологическом развитии отсутствовали или были минимальны.
Учитывая данные результаты, мы сомневаемся, что увеличение продолжительности жизни происходит вследствие замедления скорости биологического старения. Скорость старения может быть выражена показателем времени, за которое в два раза повышается смертность особей (MRDT или время удвоения интенсивности смертности). Используя аналитическую платформу Survcurv, мы определили этот параметр у модельных организмов после применения синергических комбинаций препаратов. При сочетанном действии препаратов RIF+PSORA+ALLAN уровень MRDT нематод был существенно больше, чем такой же показатель в контрольной группе(MRDT=3,7 и 3 дня, Р<0,0001, соответственно).
Уровень смертности молодых червей (IMR) в экспериментальной группе также оказался заметно ниже (IMR контрольной группы = 2.7e-3, IMR при действии RIF+PSORA+ALLAN = 8.5e-4, RAP+RIF+ALLAN = 9.3e-4, P< 0,001). Мы пришли к выводу, что благодаря применению синергических комбинаций лекарственных препаратов, замедлялся процесс старения нематод и повышалась устойчивость к различным негативным факторам у молодых особей, что в итоге привело к продлению их жизни.
Сохранение эффекта лекарственного синергизма у мух Drosophila
Одним из ключевых вопросов исследований процесса старения является вопрос переноса достигнутого результата по продлению жизни с одного на другие виды организмов. По этой причине мы изучили, будет ли эффект лекарственного синергизма, удлиняющий жизнь C.elegans, сохраняться в экспериментах на Drosophila melanogaster. Ранее в исследованиях учеными было показано, что RAP увеличивал срок жизни плодовых мушек, в то время как MET был не эффективен. Мы последовательно оценили действие отдельных препаратов и их комбинаций на время жизни самцов плодовых мушек. Вначале, мы продемонстрировали, что лекарственные соединения RAP и ALLAN удлиняли средний срок жизни плодовых мушек, тогда как RIF и PSORA повышали только максимальные показатели продолжительности жизни организмов (Схема 6, вспомогательная таблица s2).
Синергический эффект, продлевающий период жизни мушек, был выявлен у комбинаций препаратов на основе соединения RAP: RAP+RIF и RAP+RIF+ALLAN (Схема 6а). Мы не обнаружили прироста в среднем времени жизни мушек при применении комбинаций препаратов, содержащих PSORA: RIF+PSORA и RIF+PSORA+ALLAN (Схема 6b). Однако, по сравнению с результатами действия отдельных препаратов сочетание лекарств RIF+PSORA привело к синергическому эффекту, увеличивающему максимальную продолжительность жизни организмов (Схема 6с). Поскольку у плодовой мушки Drosophila melanogaster сохранялся эффект лекарственной синергии, мы считаем, что результаты нашей работы подтверждают существование эволюционно-консервативного механизма, который, обуславливает функционирование данного синергического эффекта.

Рис.6
Обсуждение
В настоящей работе нам удалось найти несколько комбинаций препаратов с синергическим действием. Они избирательно влияли на определенные сигнальные пути, ассоциированные со старением и долголетием. Кроме того, сигнальные пути могли пересекаться между собой. Даже при том условии, что такие комбинации препаратов применялись только во взрослом возрасте, продолжительность активной жизни C.elegans повышалась в два раза. Размер эффекта от лекарственных вмешательств, был сравним с эффектом после классических мутаций, замедляющих старение. Насколько нам известно, это исследование стало самым масштабным по количеству и объему лекарственных вмешательств у взрослых животных.
При использовании синергических лекарственных комбинаций, увеличивающих продолжительность жизни червей, мы не смогли обнаружить каких-либо сопутствующих отрицательных компенсаторных нарушений или нарушений в развитии животного. Подобные нарушения наблюдались у организмов с мутациями в генах, связанных со старением. Также отмеченный позитивный лекарственный эффект был не за счет снижения работы мембранной цепи транспорта электронов (ETC) или подавления метаболизма у червей. Оценка данных показателей проводилась на основании уровня потребления кислорода.
Действительно, животные, получившие лекарственные комбинации препаратов, превосходили контрольную группу организмов по показателям двигательной активности. Физическая форма и активность у старых особей в экспериментальной группе и у более молодых в контрольной группе была одинаковой (Схема 5g). Анализ смертности, показал, что синергическое действие комбинаций препаратов замедляет скорость биологического старения примерно на 20% (Дополнительная схема 10). Чтобы проверить положительный эффект лекарственного синергизма и его эволюционный консерватизм, мы выполнили несколько экспериментов на плодовой мушке Drosophila melanogaster. У двух из четырех комбинаций препаратов подтвердилась сохранность синергического действия.
Эволюционно нематоды более близки к млекопитающим, чем к мухам. Следовательно, такие консервативные механизмы и сигнальные пути у плодовых мушек и нематод являются древними. Вероятно, изначально механизм синергического действия существовал у общего для данных трех классов животных предка.
Для того чтобы изучить механизм действия лекарственной синергии, продляющей жизнь червям, мы провели несколько эпистазных экспериментов (Эпистаз-подавление действия аллельной пары генов геном не аллельной пары) и транскриптомный анализ. В результате нам удалось найти, что сигнальные пути daf-2/daf-16 (IGF/FOXO) и TGF (daf-7), играют важную роль в функционировании синергического эффекта (Схема 4j). Связь между этими двумя путями была подтверждена также в других исследованиях. Их авторы сообщают, что daf-7 регулировал продолжительность жизни животных через инсулиновый сигнальный путь, а нейронный TGF путь был ассоциирован с приемом пищевых веществ и долголетием. Кроме того, daf-7 контролировал метаболизм C. elegans и процесс запасания жира. Мутации, удлиняющие жизнь C. elegans, действовали на липидный обмен червей через повышение количества мононенасыщенных липидов и снижение количества полиненасыщенных липидов.
Данные результаты согласуются с выводами, полученными в нашем исследовании. Лекарственная синергия повышала уровень главного транскрипционного фактора sbp-1, влияющего на липидный метаболизм и синтез мононенасыщенных липидов (Схема 4с, е, дополнительная схема 5). Масс-спектральный анализ липидома нематод, у которых применялись различные комбинации препаратов с синергическим эффектом, выявил изменения в жировом обмене: активацию sbp-1-фактора, накопление триацилглицерина и увеличение соотношения моно –и полиненасыщенных липидов в сторону увеличения первых (в т.ч. в двух классов липидов – фосфатидилхолиновом и фосфатидилэтаноламиновом). Наконец, в научной литературе описано, что преобладание мононенасыщенных липидов над полиненасыщенными, найдено в липидном профиле мембран эритроцитов детей, чьи родители дожили до 90 и более лет.
В мире существует огромный интерес у ученых к потенциальной способности препарата MET и, возможно, также соединения RAP, к замедлению развития возраст-зависимых нарушений и предотвращению заболеваний человека. Учитывая повышенное внимание к этому вопросу, мы хотим упомянуть об экспериментах, в которых эффективность комбинации препаратов MET и RAP у C. elegans и мышей, оказалась слабой. Такие результаты разочаровали многих ученых.
В нашей работе, мы продемонстрировали, что продолжительность жизни определялась комплексом сигнальных путей и взаимодействующих между собой генов и биохимических молекул. Одновременное влияние на несколько мишеней определенных сигнальных путей способно привести к заметному положительному эффекту и иногда непредсказуемому результату. В настоящем исследовании, основанном на принципе доказательности, мы применяли лекарственные препараты действующие на ключевые сигнальные пути.
Неожиданно нами был открыт синергический эффект, который имел универсальный и эволюционно-консервативный характер. Результаты нашей работы подтверждают обоснованность использования для замедления скорости биологического старения лекарственных препаратов, которые точечно меняют активность сразу множества консервативных сигнальных путей. Если ученым удастся перенести подобный принцип действия на людей, то это позволит значительно повысить эффективность медицинской помощи и экономическое благосостояние общества.
Перевод: Татьяна Гнетеева.
