Приветствую всех айтишников и технарей. Не беспокойтесь, серию (1, 2) про ЯМР я не бросил, и обязательно её закончу. Однако пися пиша готовя очередную статью, посвященную возможностям метода, я столкнулся с тем, что описать и объяснить эти самые возможности можно только человеку, который понимает как устроена молекула. Таких людей на Хабре (да и в целом по жизни) не так много, а мне хотелось бы адресовать свои посты относительно широкой аудитории. Ничего подобного, как ни странно, я на Хабре не нашел, поэтому деваться некуда, придется наваять про это отдельный пост.
Теория химического строения молекул, которая была сформулирована Александром Михайловичем Бутлеровым более полтораста лет назад как чисто эмпирическая, практически в неизменном виде (только немного дополненном), и поныне является основным средством описания пространственного строения молекул. Оригинальная формулировка ТХС в духе времени весьма витиевата и неочевидна, поэтому приводить я её здесь не буду, а сразу перейду к сути. Бутлеров увязал известные уже концепции химической связи и валентности атомов воедино, представив молекулу как граф с атомами в качестве вершин и химическими связями в качестве ребер. В этом графе и вершины и ребра имеют целочисленные веса:
У связей (ребер) это кратность k (порядок), есть допустимый набор порядков связи между атомами конкретного элемента(ов). Выше 3 бывает редко
У атомов (вершин) это валентность V (координационное число), есть некий набор допустимых валентностей для каждого элемента. У водорода это 1, у кислорода 2, у углерода 4, у азота 3-4.
По мере накопления знаний о строении атома и природе химических связей, эта теория получила фундаментальное обоснование и ряд дополнений, целочисленность порядка связи, как это водится, перестала быть обязательным условием, однако основа осталась неизменной. Теоретического обоснования ТХС мы касаться не будем, пока что будем считать её чисто эмпирической.
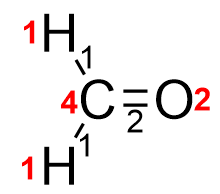
Основным условием, которое определяет порядок соединения атомов в молекулу, является условие
V = Σk
то есть сумма порядков связей, приходящих в атом, равняется его валентности. В принципе, это достаточная информация для того, чтобы сделать основные выводы относительно строения молекул. Первый вывод - строение молекулы можно однозначно и точно описать, например, строение молекулы из n атомов, как и любого графа, может быть описано матрицей n*n. Или списком из структур вида (атом А, атом В, порядок связи). Второй вывод - одному набору атомов может соответствовать несколько молекул разного строения. Такие молекулы называются изомерами. Важно понимать, что ТХС ничего не говорит о пространственном взаиморасположении атомов в молекуле - только об их связности. Поэтому одной структуре может соответствовать несколько стереоизомеров - наиболее устойчивых геометрических конфигураций этой структуры в трехмерном пространстве.
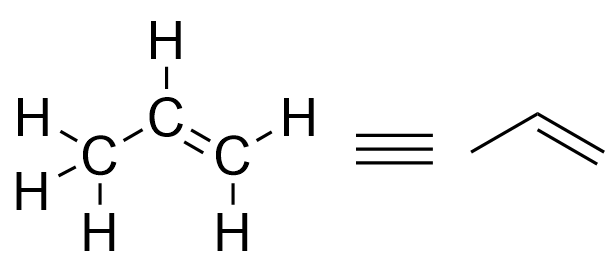
Строение молекулы можно изобразить в виде 2D проекции, например рисунком на бумаге - известной всем со школы структурной формулой. Есть разные способы проецирования молекулы на плоскость, со своими правилами отображения. Помимо классической проекции, используются Фишеровская (в основном для биохимии) и Ньюмановская (для стереохимии и конформационного анализа) проекции, а также специфические способы изображения отдельных элементов, таких как циклогексан (кресло-ванна). Правила изображения структурных формул позволяют сохранить стереохимическую информацию, поэтому опытный органик без труда по картинке построит в своем воображении 3D модель не слишком большой молекулы. Чтобы было проще изображать и воспринимать структурные формулы, атомы водорода не обозначают (т.к. валентность у них всегда 1, а, следовательно, и порядок связи с ними тоже 1), а вместо атомов углерода рисуют просто вершины.
Переходя от межатомной связности к пространственному строению, надо учитывать, что элементы строения, связи и атомы, имеют геометрический размер в трехмерном пространстве. Надо понимать, что ядро атома - очень маленькая штука, поэтому реальный размер элементов строения молекулы определяется размером их электронных облаков. Так как электроны это совершенно квантовые объекты, размер их облаков - это не строгий параметр, а некая область пространства, но для наших целей достаточно аппроксимировать их заключающими (нестрого, скажем, 95% электронной плотности) геометрическими телами: атомы - шариками, а связи - палочками или цилиндрами (Ball and stick model). Такая модель дает уже вполне адекватное представление о пространственном строении молекулы. Также надо понимать, что эти объекты, находясь вблизи друг друга, отталкиваются. Детально рассматривать природу и характер сил межатомного и межмолекулярного взаимодействия я не буду, скажу только, что в отличие от макроскопических объектов привычного нам масштаба, чем ближе находятся эти объекты, тем сильнее они отталкиваются. В потенциал Леннарда-Джонсона и глубже мы копать не будем, но уже из этого можно сделать закономерный вывод - связи (а также и неподеленные электронные пары), исходящие из одного атома, будут отталкиваться друг от друга, и в итоге примут положение наибольшего взаимоудаления друг от друга.
Из этого постулата растут ноги у теории ОЭПВО - отталкивания электронных пар валентной оболочки. Принимается, что электронные пары (неважно, связевые или неподеленные) вокруг атома отталкиваются друг от друга одинаково, а посему задача определения пространственного взаиморасположения n заместителей и неподеленных пар конкретного рассматриваемого атома определяется правильным n-вершинным полиэдром, потому что именно в нем вершины наиболее удалены друг от друга при равном их удалении от центра. Для n = 2 это отрезок, для n = 3 плоский треугольник, для n = 4 тетраэдр, ну и так далее. Соответствующие полиэдры до n = 6 изображены на рисунке ниже, снабженные примерами конкретных молекул. Почему до n = 6? Потому что ОЭПВО работает только для непереходных элементов, а у них больше 6 пар в валентной оболочке - редкость.
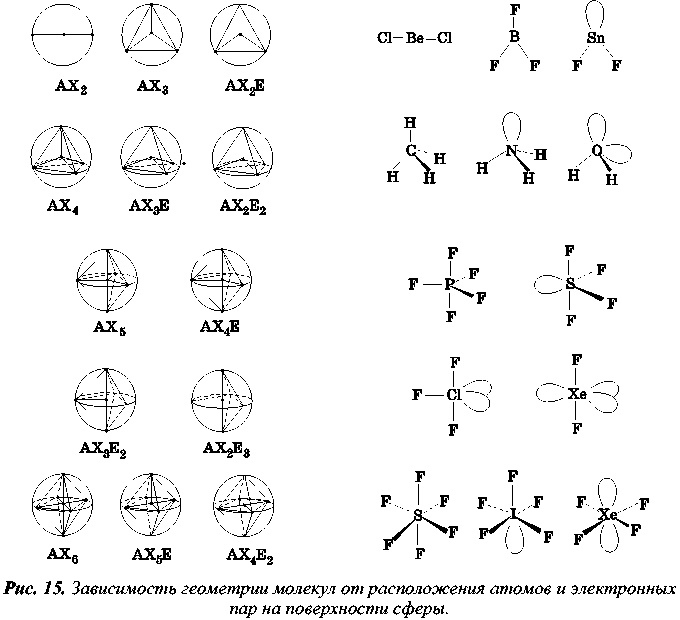
Из рисунка отлично видно, почему метан тетраэдрический, аммиак пирамидальный а вода имеет форму тупого угла. Во всех трех молекулах центральный атом (углерод, азот и кислород, соответственно) имеет тетраэдрическую конфигурацию с углами при нем ~109 °, но у углерода все четыре вершины заняты заместителями, у аммиака - три, а у воды - только две. Для переходных элементов (периоды с 3 по 12 в длинном представлении), а также для некоторых тяжелых атомов ОЭПВО не работает, там используется ТКП - теория кристаллического поля, и более сложные теории, касаться которых мы не будем. В ситуации, когда ближайшее окружение атома анизотропно, то есть заместители имеют разный реальный объем и отталкиваются по-разному, или существует геометрическое напряжение (например в циклопропане), конфигурация соответствует искаженному тетраэдру, однако в большинстве случаев искажения не столь велики. На круг, теория ОЭПВО дает нам очень важную информацию - углы между связями при каждом атоме.
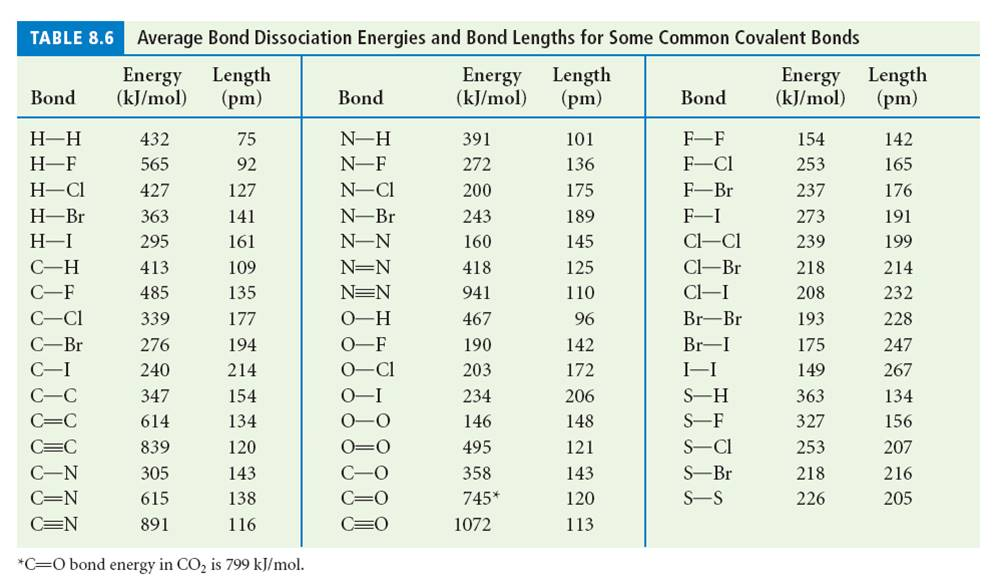
Углы у нас есть, а что же с межатомными расстояниями? А с ними всё просто. Для каждой пары элементов (A, B) и порядка связи k длина этой связи находится в довольно узком диапазоне шириной в пару-тройку процентных пунктов. И отклонения от этого связаны обычно с тем, что реальный порядок связи отличается от целочисленного. Поэтому все длины связей давным-давно протабулировали и являются справочной информацией. Для, скажем так, популярных связей, например С-С, часто приводится набор значений для разных типов химического окружения. Существуют многотомные справочники и интернет-ресурсы, где проиндексировано огромное количество данных по длинам химических связей в различных соединениях.
Итак, мы знаем связность атомов, мы знаем углы, мы знаем длины связей. И это, в общем-то, почти весь джентельменский набор, необходимы для понимания строения молекулы. Осталось только явление стереоизомерии, но на неё у меня уже не хватит сегодня сил, и я позволю себе отделить её в отдельный пост. А в остальном, изложенной сегодня информации вполне достаточно для того, чтобы представлять себе строение молекулы органического соединения, что позволит нам продолжить обсуждение метода ЯМР и его возможностей в применении к органическим соединениям. Для желающих пощупать строение молекул вживую - могу порекомендовать бесплатную рисовалку MolView, в которой можно порисовать плоские структурные формулы (водороды он добавляет автоматически, прямо как сознание химика-органика), а по нажатию кнопки "2D to 3D" преобразовать это в трехмерную вращабельную структуру, которая, кстати, как раз генерируется на основе ОЭПВО и табличных длин связей. Мы в работе, конечно, используем другие инструменты, например ChemDraw для рисования и Gaussian для расчетов и визуализации, но они весьма и весьма платные, а MolView фриварная и онлайновая)
Надеюсь, у меня в будущем будет (нет) больше свободного времени для того, чтобы закончить цикл по ЯМР и начать что-нибудь не менее интересное, про приборы и методы исследования в химии.