Не так давно нашей пресс-службой был подготовлен материал по исследованиям Ведущего ученого член корр. РАН, д.ф. – м.н. Хазанова Ефима Аркадьевича. Интервью ведущего ученого было опубликовано на множестве ресурсов, с некоторыми из них можно ознакомиться, пройдя по следующим ссылкам: Диагностировать и лечить рак поможет лазер и Профессор Хазанов: «скоро мы научимся лечить раковые клетки лазером». Речь шла об инновационном способе диагностики и лечении онкозаболеваний при помощи лазерно-плазменного ускорителя протонов. Для полноценного погружения в суть исследования мы попросили ведущего научного сотрудника Константина Юшкова рассказать, как и на каком оборудовании происходит сам процесс исследования и создание прототипа.
Под катом Вы найдете много информации о проекте, оборудовании, уникальности исследования. Мы подготовили фоторепортаж, который описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов и раскрывает её значение.

Лаборатория «Физические методы акустооптическая и лазерная аппаратура для задач диагностики и терапии онкологических заболеваний»
На базе новой лаборатории НИТУ «МИСиС» под руководством доктора физико-математических наук, член-корреспондента РАН Ефима Хазанова, Институт прикладной физики РАН, разрабатываются способы диагностики и терапии онкологических заболеваний с помощью лазерных технологий и создается компонентная база для лазерно-плазменного ускорителя протонов, одним из приложений которого является терапия рака.
Научный коллектив лаборатории объединил усилия ведущих специалистов в области акустооптики и систем обработки изображений (НИТУ «МИСиС»), лазерной физики (ИПФ РАН, г. Нижний Новгород), онкологии (ЭНЦ РАМН, Биологический факультет МГУ им. М.В. Ломоносова), кристаллофизики (ТвГУ, г. Тверь). В рамках реализации проекта был создан уникальный комплекс научно-исследовательской аппаратуры, позволяющий проводить исследования в области биомедицинской оптики.
Своей основной целью лаборатория ставит создание новых акустооптических систем гиперспектральной лазерной флуоресцентной диагностики онкологических заболеваний и акустооптических приборов для фемтосекундных лазерных комплексов адронной терапии онкологических заболеваний. Данный проект представляет уникальное сочетание современных разработок в области оптики и лазерной физики с применениями в биомедицинской области (онкологии). Актуальность поставленных задач обусловлена направленностью на создание ключевых компонентов нового поколения установок адронной терапии онкологических заболеваний, основанных на компактных лазерных источниках и ускорителях заряженных частиц высоких энергий. Также в проекте решается задача формулирования новых диагностических критериев при дифференциальной диагностике и определении злокачественности опухолей человека.
Результаты, которые были достигнуты коллективом лаборатории:
1. Создан экспериментальный прототип акустооптической гиперспектральной системы с возможностью пространственной фильтрации и оконтуривания изображений.
2. Создан лазерный драйвер фотокатодов для инжекции электронов с акустооптической системой управления ультракороткими лазерными импульсами.
3. Исследования в области акустики и оптики анизотропных сред позволили определить оптимальные конфигурации широкоапертурных и квазиколлинеарных акустооптических фильтров на основе монокристаллов парателлурита.
4. Проведены гиперспектральные исследования флуоресцентного излучения опухолевых тканей щитовидной железы человека.
5. Разработаны методы формирования произвольных спектральных функций пропускания акустооптических фильтров.
Система гиперспектрального анализа и лазерного исследования микроскопических препаратов
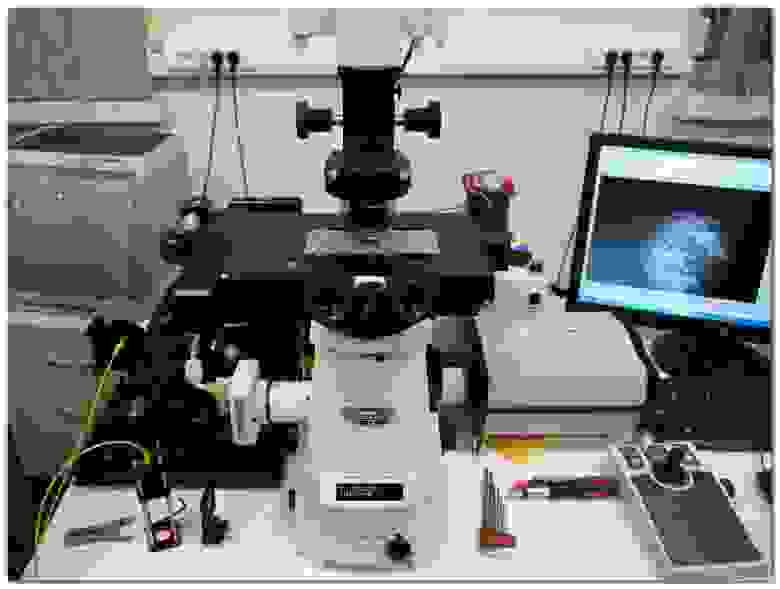
Система построена на базе инвертированного микроскопа Nikon Ti-E с набором объективов от 4x до 100х
 Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
 Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
 Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
 Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
 Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
 В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
 Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
 Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
 Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
 Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
 Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
 Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
 В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
 Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
 Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
 Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Под катом Вы найдете много информации о проекте, оборудовании, уникальности исследования. Мы подготовили фоторепортаж, который описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов и раскрывает её значение.

Лаборатория «Физические методы акустооптическая и лазерная аппаратура для задач диагностики и терапии онкологических заболеваний»
На базе новой лаборатории НИТУ «МИСиС» под руководством доктора физико-математических наук, член-корреспондента РАН Ефима Хазанова, Институт прикладной физики РАН, разрабатываются способы диагностики и терапии онкологических заболеваний с помощью лазерных технологий и создается компонентная база для лазерно-плазменного ускорителя протонов, одним из приложений которого является терапия рака.
Научный коллектив лаборатории объединил усилия ведущих специалистов в области акустооптики и систем обработки изображений (НИТУ «МИСиС»), лазерной физики (ИПФ РАН, г. Нижний Новгород), онкологии (ЭНЦ РАМН, Биологический факультет МГУ им. М.В. Ломоносова), кристаллофизики (ТвГУ, г. Тверь). В рамках реализации проекта был создан уникальный комплекс научно-исследовательской аппаратуры, позволяющий проводить исследования в области биомедицинской оптики.
Своей основной целью лаборатория ставит создание новых акустооптических систем гиперспектральной лазерной флуоресцентной диагностики онкологических заболеваний и акустооптических приборов для фемтосекундных лазерных комплексов адронной терапии онкологических заболеваний. Данный проект представляет уникальное сочетание современных разработок в области оптики и лазерной физики с применениями в биомедицинской области (онкологии). Актуальность поставленных задач обусловлена направленностью на создание ключевых компонентов нового поколения установок адронной терапии онкологических заболеваний, основанных на компактных лазерных источниках и ускорителях заряженных частиц высоких энергий. Также в проекте решается задача формулирования новых диагностических критериев при дифференциальной диагностике и определении злокачественности опухолей человека.
Результаты, которые были достигнуты коллективом лаборатории:
1. Создан экспериментальный прототип акустооптической гиперспектральной системы с возможностью пространственной фильтрации и оконтуривания изображений.
2. Создан лазерный драйвер фотокатодов для инжекции электронов с акустооптической системой управления ультракороткими лазерными импульсами.
3. Исследования в области акустики и оптики анизотропных сред позволили определить оптимальные конфигурации широкоапертурных и квазиколлинеарных акустооптических фильтров на основе монокристаллов парателлурита.
4. Проведены гиперспектральные исследования флуоресцентного излучения опухолевых тканей щитовидной железы человека.
5. Разработаны методы формирования произвольных спектральных функций пропускания акустооптических фильтров.
Оборудование:
• Фемтосекундный лазер Femtosource Synergy (Femtolasers, Австрия).
• Фемтосекундный автокоррелятор Femtometer (Femtolasers, Австрия).
• Усилитель регенеративный RAP-2000 (Авеста-проект, Россия).
• Система диагностики ультракоротких лазерных импульсов MIIPSBox-640 (Biophotonic Solitions, США).
• Генератор сигналов произвольной формы N8241A (Agilent, США).
• Генератор сигналов произвольной формы 33622А (Keysight, США).
• Оптический анализатор спектра 86142В (Agilent, США).
• Аргоновый лазер 488 нм (Melles Griot, США).
• Твердотельный лазер 532 нм (Laser Quantum, Великобритания).
• ВЧ-усилители (Amplifier Research, США).
• Анализатор спектра радиосигналов FSH3 (Rhode&Schwarz, Германия).
• Измеритель мощности радиосигналов NRT-Z14 (Rhode&Schwarz, Германия).
• Рентгеновский дифрактометр (Rigaku, Япония).
• Автоматизированная установка для резки кристаллов и пластин APD2 (Logitech, Великобритания).
• Шлифовально-полировальный оптический станок OLP 200/C (AKM, Германия).
• Интерферометр OptoTL-60 (Оптико-технологическая лаборатория, Россия).
• Ультразвуковая линия отмывки (Selecta, Испания).
• Установка вакуумного напыления (Torr, США)
• Установка термокомпрессионной сварки (Kulicke&Soffa, США).
• Векторный анализатор цепей E5061A (Agilent, США).
• Микроскоп медико-биологический Ti-E (Nikon, Япония).
• Гиперспектральная система HSi-300 (Gooch & Housego, США).
• Охлаждаемая ПЗС-Камера Alta U32 (Apogee Instruments, США).
• Прецизионные оптические столы (Thorlabs, США).
• Оптическая станция (Thorlabs, США).
• Фемтосекундный автокоррелятор Femtometer (Femtolasers, Австрия).
• Усилитель регенеративный RAP-2000 (Авеста-проект, Россия).
• Система диагностики ультракоротких лазерных импульсов MIIPSBox-640 (Biophotonic Solitions, США).
• Генератор сигналов произвольной формы N8241A (Agilent, США).
• Генератор сигналов произвольной формы 33622А (Keysight, США).
• Оптический анализатор спектра 86142В (Agilent, США).
• Аргоновый лазер 488 нм (Melles Griot, США).
• Твердотельный лазер 532 нм (Laser Quantum, Великобритания).
• ВЧ-усилители (Amplifier Research, США).
• Анализатор спектра радиосигналов FSH3 (Rhode&Schwarz, Германия).
• Измеритель мощности радиосигналов NRT-Z14 (Rhode&Schwarz, Германия).
• Рентгеновский дифрактометр (Rigaku, Япония).
• Автоматизированная установка для резки кристаллов и пластин APD2 (Logitech, Великобритания).
• Шлифовально-полировальный оптический станок OLP 200/C (AKM, Германия).
• Интерферометр OptoTL-60 (Оптико-технологическая лаборатория, Россия).
• Ультразвуковая линия отмывки (Selecta, Испания).
• Установка вакуумного напыления (Torr, США)
• Установка термокомпрессионной сварки (Kulicke&Soffa, США).
• Векторный анализатор цепей E5061A (Agilent, США).
• Микроскоп медико-биологический Ti-E (Nikon, Япония).
• Гиперспектральная система HSi-300 (Gooch & Housego, США).
• Охлаждаемая ПЗС-Камера Alta U32 (Apogee Instruments, США).
• Прецизионные оптические столы (Thorlabs, США).
• Оптическая станция (Thorlabs, США).
Система гиперспектрального анализа и лазерного исследования микроскопических препаратов
 |
Константин Юшков, Ведущий научный сотрудник |
Гиперспектральный анализ заключается в получении и массива изображений исследуемого объекта на различных длинах волн и последующем изучении спектральных особенностей различных фрагментов изображения. Основы технологии гиперспектрального анализа, называемые также спектрозональной съемкой, были разработаны для решения задач астрофизики, космических исследований и дистанционного зондирования Земли. В последние годы эти методы стали внедряться и в биомедицинских исследованиях, в частности в диагностика рака. Получаемый при гиперспектральном анализе объем информации об объекте существенно превосходит цветные изображения: спектральное разрешение современных гиперспектральных систем составляет несколько сот линий в видимом диапазоне спектра, в то время как цветная (RGB) камера выделяет только три широких спектральных диапазона (красный, зеленый и синий). Одним из физических приборов, позволяющих реализовать спектрометр изображений, являются перестраиваемые акустооптические фильтры.
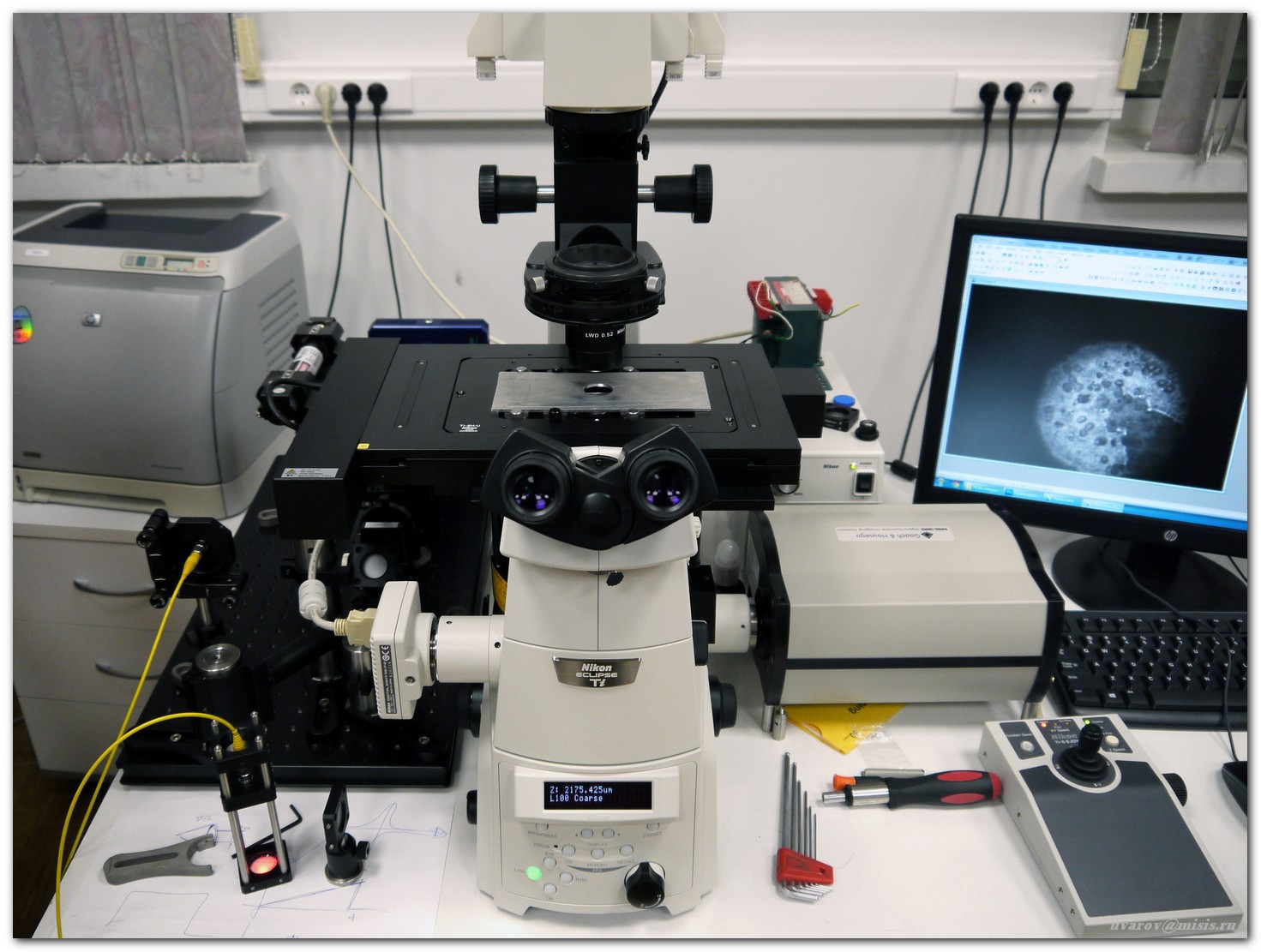
Система построена на базе инвертированного микроскопа Nikon Ti-E с набором объективов от 4x до 100х
 Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры
Визуальный контроль осуществляется через окуляр или при помощи штатной цветной камеры Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа
Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)Наблюдаемое при этом изображение объекта содержит информацию о спектральных кривых пропускания образца, которая, однако, теряется при регистрации обычной ПЗС-камерой. Кроме того, при наблюдении объекта в белом свете можно увидеть только амплитудную модуляцию, то есть различие между более и менее прозрачными фрагментами изображения. Фазовая модуляция, обусловленная вариациями толщины образца или его показателя преломления, может быть визуализирована только в когерентном освещении и с помощью специальных систем пространственной фильтрации. Один из классов таких систем – акустооптические фильтры изображений, неоспоримым достоинством которых является адаптивность, то есть возможность изменять характеристики в ходе эксперимента в зависимости от поставленной задачи.
 Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект
Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов
Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром
В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра
Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображенийАкустооптический фильтр является ключевым звеном данной системы и позволяет осуществлять обработку изображений в двух принципиально различных режимах:
• при белом освещении осуществляется гиперспектральный анализ, то есть последовательное выделение различных длин волн из спектра пропускаемого объектом излучения и регистрация массива спектральных изображений (т.н. «гиперспектральный куб»);
• при лазерном освещении осуществляется адаптивная пространственная фильтрация изображений, позволяющая реализовать такие режимы аналоговой обработки, как оконтуривание (подчеркивание градиентов интенсивности) и визуализация фазы (то есть наблюдение вариаций оптической плотности объекта, не регистрируемых при освещении белым светом).
Для повышения чувствительности в качестве детекторов используются черно-белые охлаждаемые ПЗС-камеры с низким уровнем шумов, а длина волны сохраненного изображения, то есть его цвет, определяются настройкой акустооптического фильтра. При постобработке из гиперспектрального массива изображений может быть восстановлено цветное изображение или использована цветовая схема false color для повышения визуальной контрастности деталей.
 Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора
Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.
Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.  Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.
Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм. Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)
Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа) В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock
В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе
Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе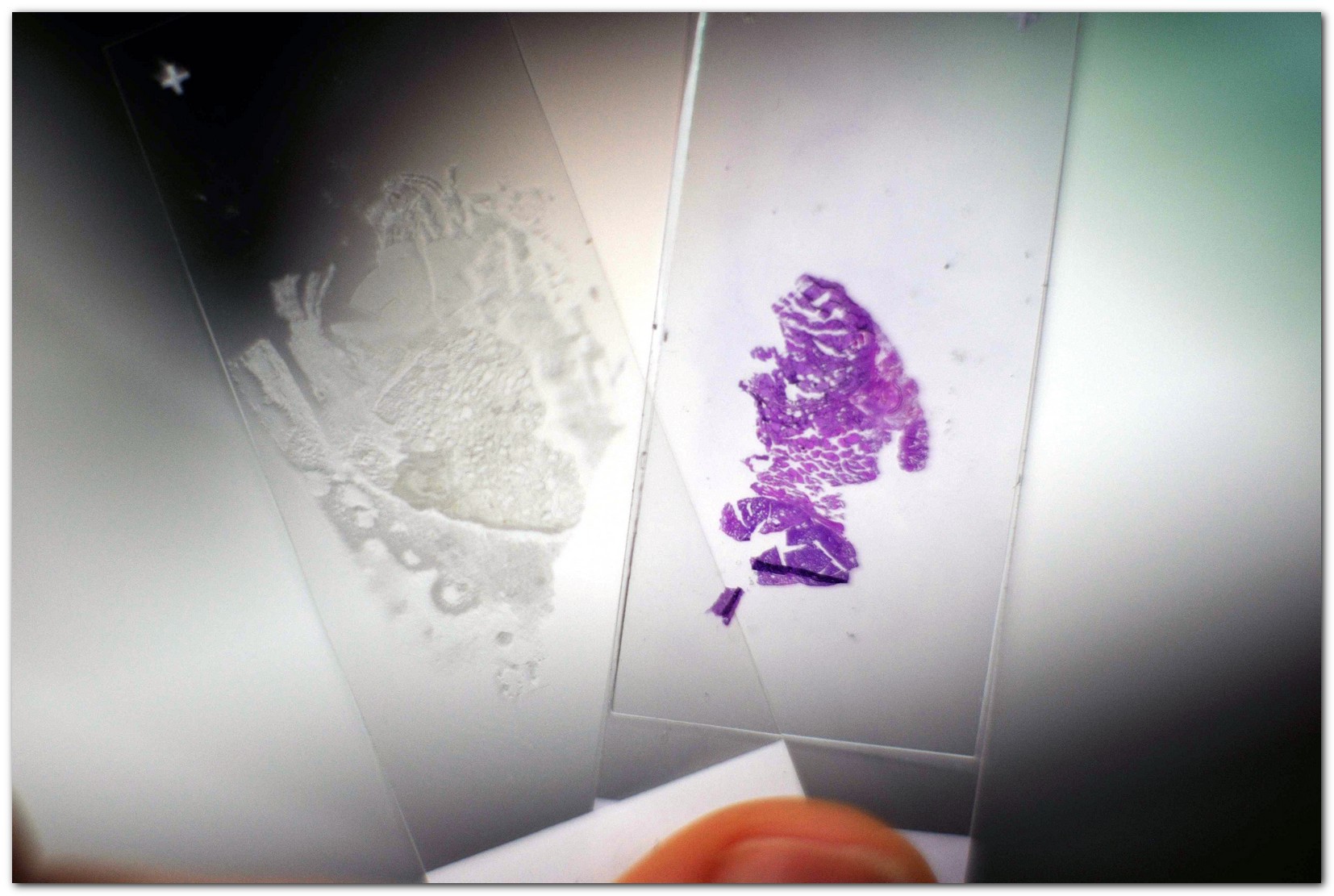 Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека
Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной тканиСравнение изображений, полученных различными методами: обычное цветное изображение, гиперспектральные черно-белые изображения, флуоресцентное изображение,– позволяет подробно исследовать особенности различных тканей и получить дополнительную информацию об их строении. Исследование спектров флуоресценции позволяет наблюдать некоторые особенности тканей, не определяемые при обычной световой микроскопии.
Сочетание в одной оптической схеме двух физических различных методов обработки изображений: гиперспектрального анализа и пространственной фильтрации является основным преимуществом разработанной в НИТУ «МИСиС» системы для исследования гистологических срезов опухолевых тканей. Эта аппаратура открывает новые возможности визуализации внутриклеточных структур и разработки новых диагностических критериев в онкологии. В перспективе система позволит реализовать дополнительные режимы визуализации объекта и интегрировать новые модули, такие как фемтосекундная система возбуждения многофотонной флуоресценции.