Принцип запрета Паули с однозначной многочастичной волновой функцией эквивалентен требованию, чтобы волновая функция была антисимметричной по отношению к обмену частицами. Как это объяснить на пальцах? Легко - ткните пальцем в стол, в монитор, во что-нибудь твердое. Глубоко пронзили материю? Удалось достичь перекрывания атомных электронных облаков пальца и стола? Нет? Не удивительно. Читайте дальше, если хотите узнать, почему так.
Спин
Цитата из Википедии: Принцип исключения Паули (принцип запрета Паули или просто принцип запрета) — это квантово-механический принцип, который гласит, что два или более идентичных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии в квантовой системе.
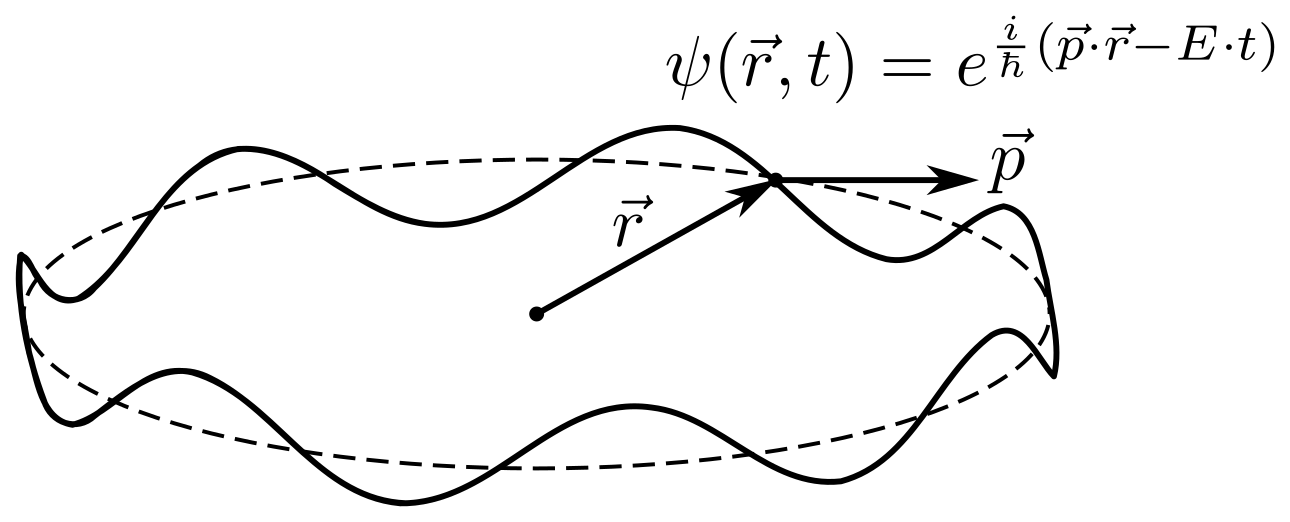
Что-то про спин. Начнём с того, что такое спин, в частности, полуцелый спин. Пускай частица движется по окружности длины , а через
мы обозначим позицию частицы. Частица будет описываться волновой функцией
. Для простоты положим, что это самая обычная бегущая волна.
Волновая функция должна однозначно определяться на окружности, а поворот на
радиан никак не должен её изменять, то есть:
Экспонента в мнимой степени это тригонометрическая функция, как синус или косинус, по сути мы записали, что волновая функция периодическая. Это возможно только если произведение
, где n - обязательно целое число. Вспомнив, что произведение
ничто иное как момент импульса, для нашей частицы мы получаем условие:
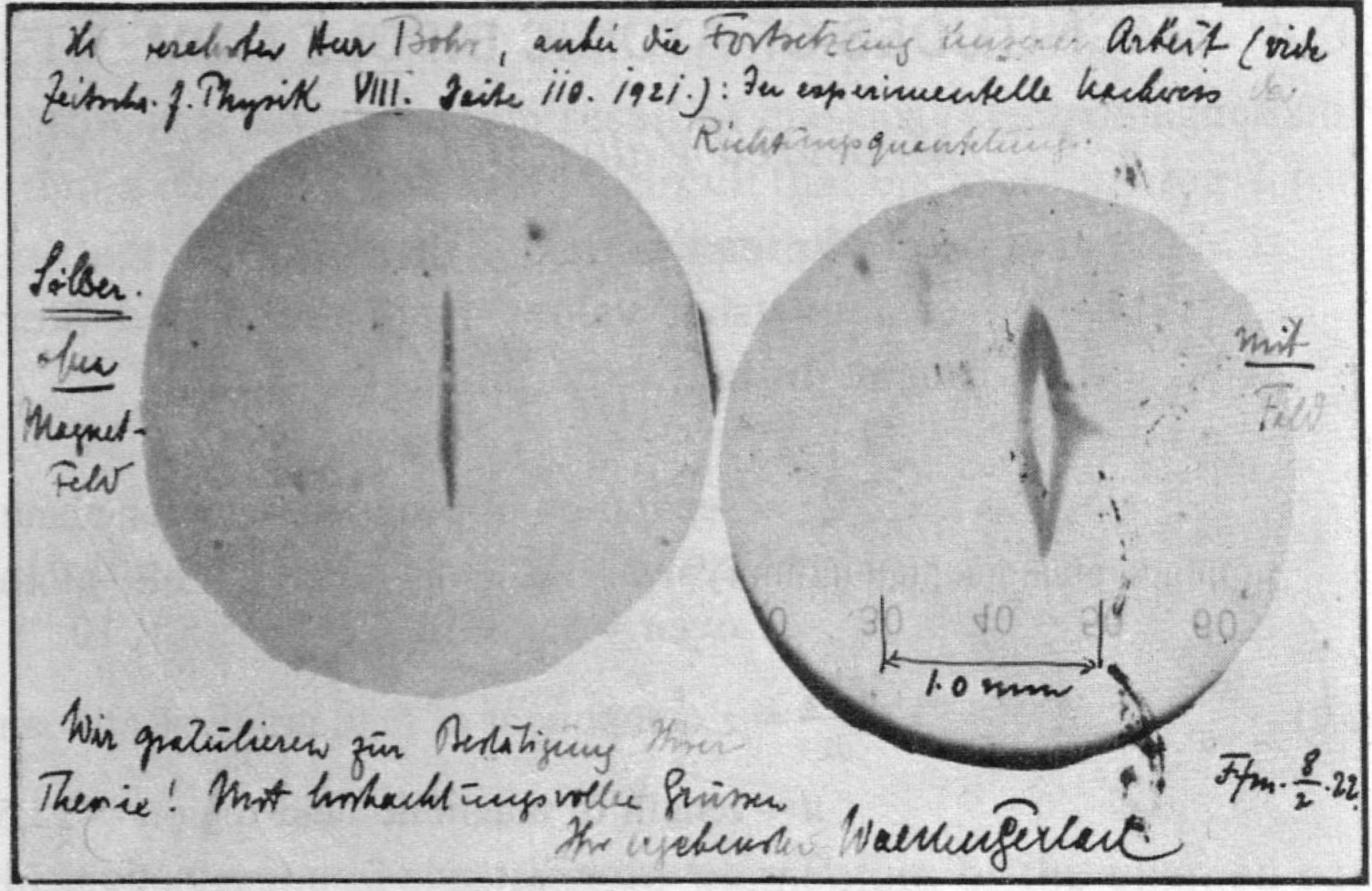
Всё это хорошо, но Отто Штерн и Вальтер Герлах установили, что электрон может так вращаться, что совершив полный оборот он не придёт в тоже самое состояние, что и раньше. А вот если два оборота сделает, тогда всё хорошо. В его случае n=1/2 и он может крутиться с периодичностью . Если Вы тоже задали себе этот вопрос: а что, черт возьми, курили эти ученые, то вам поможет удовлетворить любопытство эта статья - Stern and Gerlach: How a Bad Cigar Helped Reorient Atomic Physics.

Хорошие новости - в трехмерном пространстве есть такой тип вращения. Забавная особенность - такое вращение не перекручивает подсоединенные к телу верёвки. Попробуйте этот трюк в баре с кружкой пива - Вы сможете её постоянно поворачивать не перекручивая свою руку.
Антисимметричность по отношению к обмену электронов
Перестановка двух связанных друг с другом объектов трехмерного пространства эквивалентна повороту одного из них на 360 градусов. Значит, если периодичность вращения объекта - то перестановка приводит к смене его волновой функции. Две смены знака:
.
Обязательную смену знака волновой функции при перестановке двух частиц со спином можно трактовать как требование не перекручивать связывающее их пространство [См. Pauli principle in Euclidean geometry]. Эта лента гибкая, но до определенных пределов. Давайте установим предел гибкости нашего пространства-времени на скручивание.
Следующий пример описывается в статье Вайскопф, В. Современная физика в элементарном изложении. УФН 103(1) (1971) 155-179. Пусть есть два электрона с волновыми функциями:
Забудем пока об электростатическом отталкивании, просто летят два электрона с импульсами
на встречу друг другу. Расстояние между ними
. Волновая функция этой системы электронов:
однако, она в таком виде еще не обладает свойством антисимметрии. Легко поправить дело:
тогда перепишем её как:
Плотность вероятности имеет вид:
где - волновое число. Для всех возможных импульсов со средним значением
плотность вероятности
есть интеграл по всем волнам с различными значениями k. После интегрирования получаем, что
имеет вид ступени.
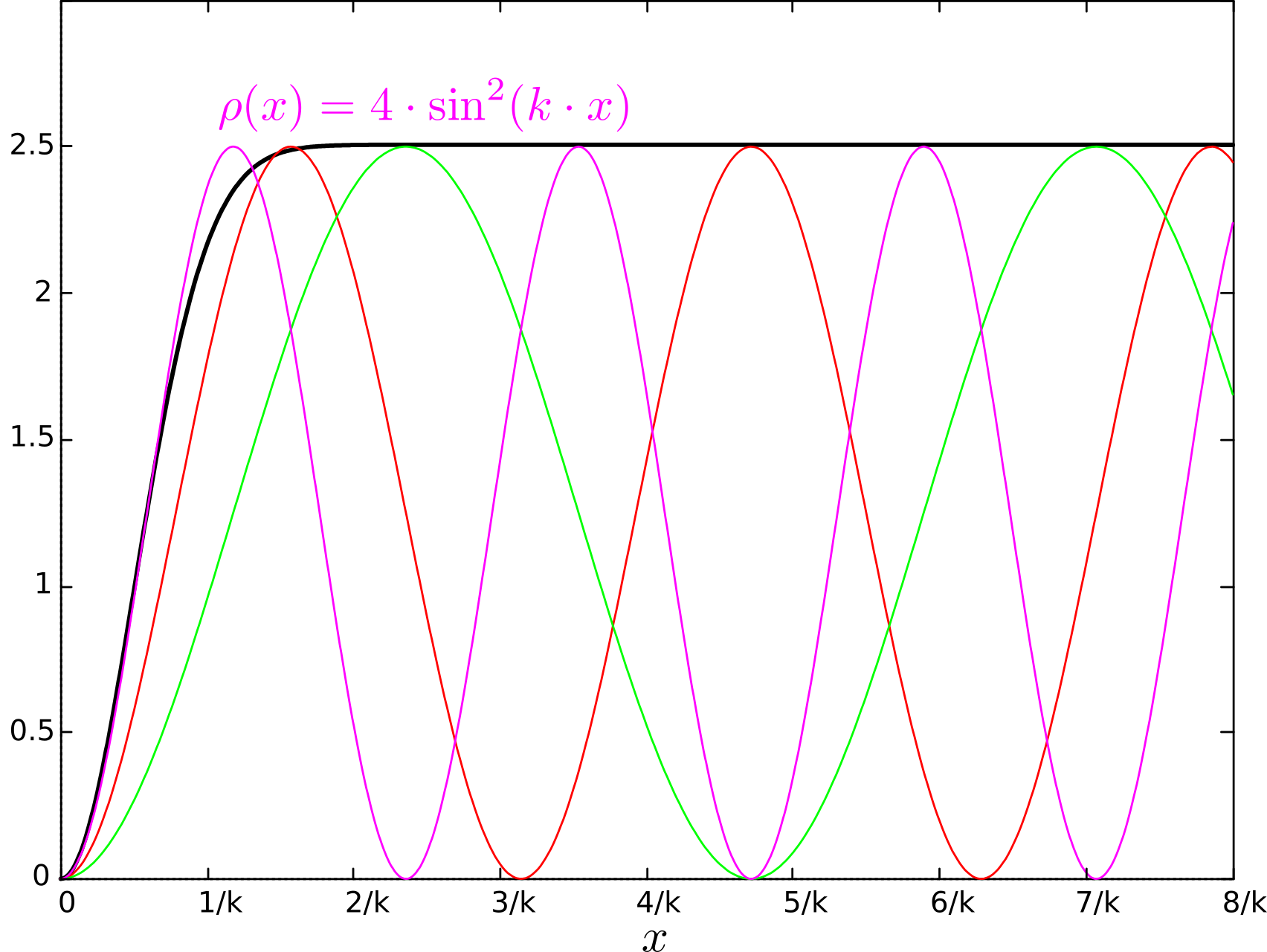
Плотность вероятности встречи электронов на расстоянии менее стремится к нулю. Минимальное возможное расстояние между ними, как видно, имеет порядок их средней длины волны, т.е.
. Именно так получается характерный объём пространства, занимаемый электроном. Как будто электрон - упругий шарик.
Принцип запрета Паули

Расположим шарики-электроны плотной упаковкой, т.к. положительно заряженное ядро стягивает их к себе, а принцип Паули и кулоновское отталкивание мешают подходить им близко друг к другу. В полученной структуре шарики расположены слоями - наружный слой, средний, внутренний. Места в пространстве у шариков однозначно задаются адресами из трех целых чисел. (Подробнее см. в Stevens, P.S. A Geometric Analogue of the Electron Cloud. Proceedings of the National Academy of Sciences 56(3) (1966) 789-793.) Смотрите на картинку.
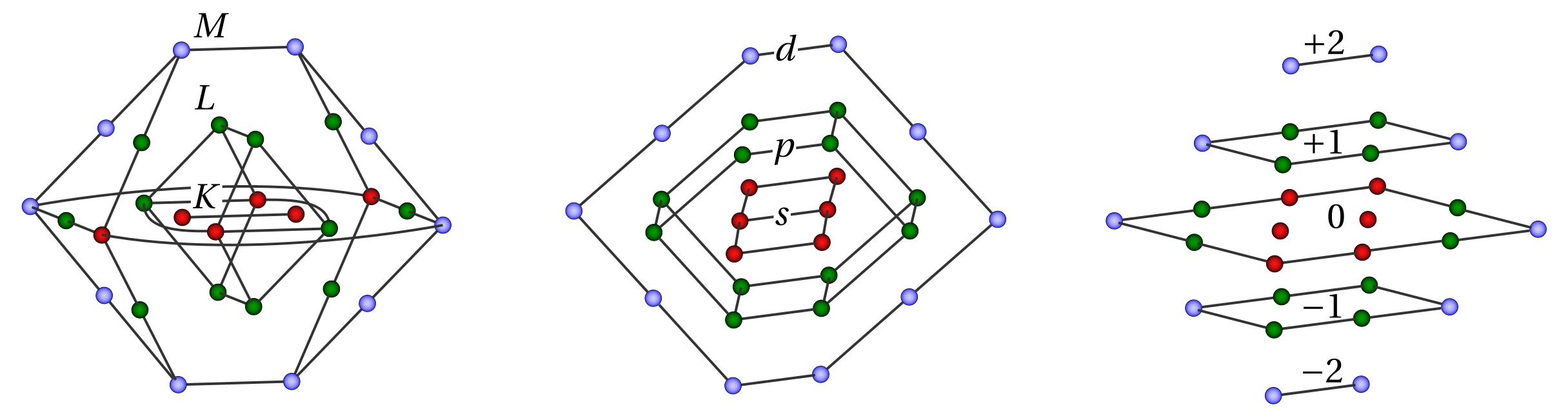
Если считать, что четвертое число - окраска шара (черная/белая, спин +1/2 или -1/2), получим, что принцип запрета Паули (нет двух электронов в атоме с одинаковым набором четырех квантовых чисел) эквивалентен однозначности адресации шара в плотной упаковке.
В свою очередь, атомы в веществе, как правило, стремятся плотно заполнить пространство. Пустого места нет, и метафора с электронными облаками, а облака могут проникать друг в друга, здесь неуместна. Материя плотная и мы это чувствуем физически.
Октет Льюиса, двойной квартет Линнета
Стремление к заполнению оболочки (правило 8 электронов, правило 18 электронов) есть ничто иное, как попытка электронов атома выстроить максимально плотную и симметричную структуру. Более того, октет Льюиса как раз исторически произошёл от кубической модели атома. С появлением квантовой механики о кубе забыли, но правило октета осталось в школьных учебниках.
В 1961 году Линнет выдвинул интересную модификацию правила октета Льюиса (см. Дей К., Селбин Д. Теоретическая неорганическая химия. М.: "Химия" 1976. Стр. 197). Он предположил, что ключевым принципом построения оболочки должно быть максимальное отталкивание электронов одного спина. Учитывая, что они же стягиваются к ядру атома, получается плотная упаковка - тетраэдр. Устойчивой оболочкой Линнет считал ориентацию двух тетраэдров, обеспечивающую их максимальное отталкивание, т.е. 4+4=8, куб. Пока мы не рассматриваем спин, его правило не отличается от правила октета, однако, оно приводит к геометрической трактовке связи. Например, отличие однократной, двойной и тройной связей выглядит так:
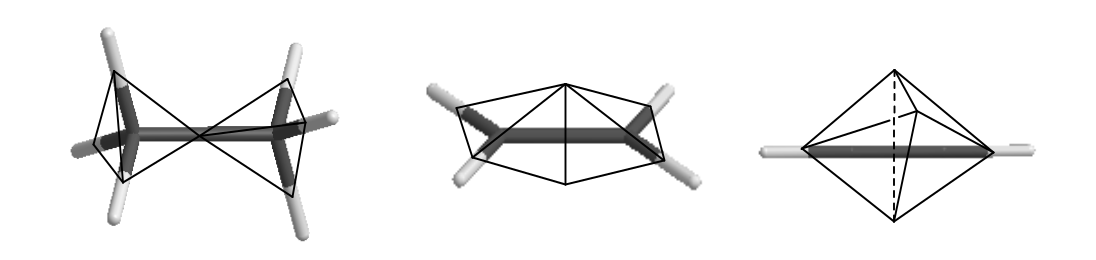
Интересно, что предсказываемые соотношения для длин связей находятся в прекрасном согласии с наблюдаемой геометрией молекул. Более того, его принцип позволяет объяснить электронную структуру молекулы кислорода, для которой основное состояние - триплет, два неспаренных электрона. Правило октета в данном случае бессильно.
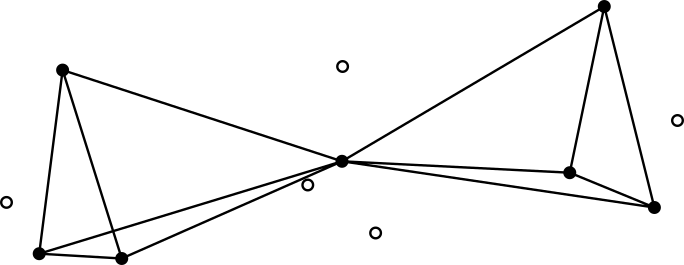
Долгое время было загадкой, почему две молекулы NO (свободные радикалы) не образуют устойчивый димер, в отличие от циана CN, который димеризуются в дициан C2N2. С позиции теории двойного квартета, структура O=N-N=O потребовала бы пространственного совмещения тетраэдров электронов разного спина, что невыгодно из-за электростатического отталкивания, тогда как дициан позволяет минимизировать отталкивание электронов. Принцип плотной упаковки электронов описывает все типы химических связей: ковалентную с кратными связями, ионную, а также металлическую связь.
Расчёт координат центроидов локализованных орбиталей Бойса у кислорода
! Используем программу GAMESS US
$CONTRL SCFTYP=UHF MULT=3
LOCAL = BOYS
RUNTYP=ENERGY NZVAR=0
$END
! PRTLOC = a flag to control supplemental printout. The
! extra output is the rotation matrix to the
! localized orbitals, and, for the Boys method,
! the orbital centroids, for the Ruedenberg
! method, the coulomb and exchange matrices,
! for the population method, atomic populations.
! (default=.FALSE.)
$LOCAL PRTLOC=.T. $END
$SYSTEM TIMLIM=100 MWORDS=5 $END
$BASIS GBASIS=STO NGAUSS=3 $END
$GUESS GUESS=HUCKEL $END
$DATA
Cnv 4
O 8.0 0.0 0.0 0.000
O 8.0 0.0 0.0 1.210
$END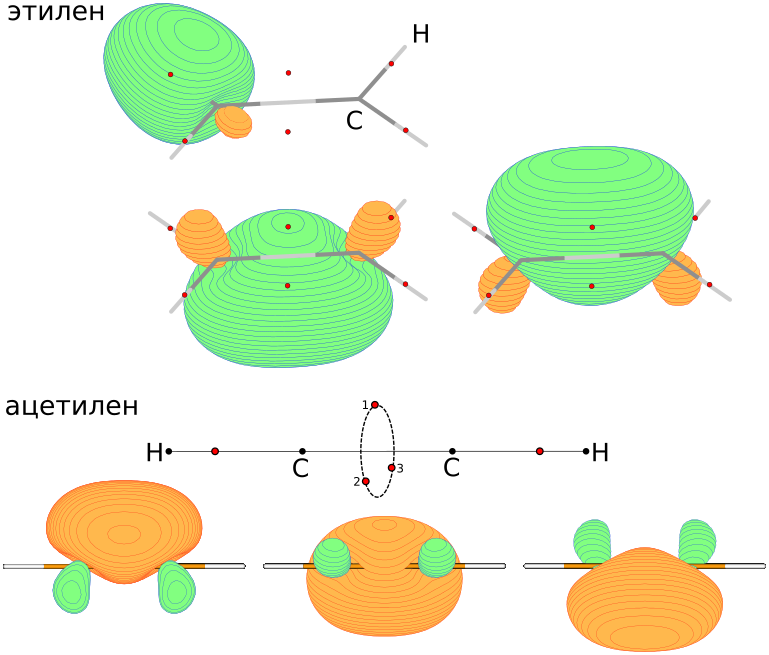
Орбитали Бойса, как видно из картинки выше, отличаются от "традиционных" представлений о различии связей π-типа и σ-типа. Моё мнение - концепция Линнета куда как больше подходит к школьному курсу химии, чем существующий набор разрозненных представлений - правило Льюиса, гибридизация, орбитали... Электроны и ядра, связанные классическими механическими силами, выстраивают атомы и связи, последние, в свою очередь, образуют механическую молекулярную систему - появляется понятие о конформации молекул.
Потенциал Гейзенберга
Соотношение неопределённости , как и принцип Паули, также интерпретируется с позиций механики. Рассмотрим атом водорода. Запишем импульс электрона -
, а радиус его орбиты -
. Имеем:
. Полная энергия атома (в системе атомных единиц):
Тогда c учётом соотношения неопределенности имеем:
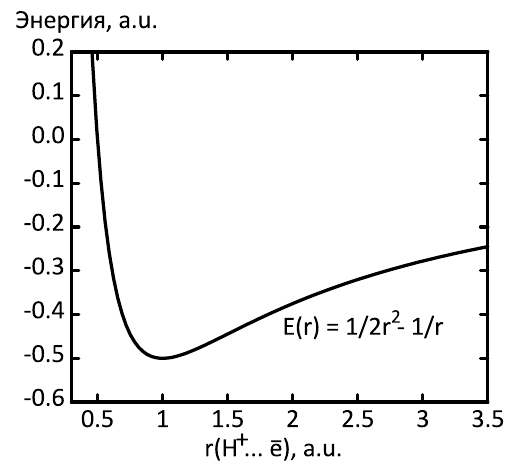
В точке минимума энергия атома водорода
как и должно быть по законам квантовой механики. Вид потенциала аналогичен таковому у шарика на упругой пружинке. Воспользуемся найденным потенциалом для поиска кривой потенциальной энергии молекулярного иона
.
Пусть электрон в молекулярном ионе находится на линии связи H-H, на расстояниях от центров
,
. Тогда статическое равновесие сил записывается как:
Решим систему уравнений и найдем зависимость полной энергии иона от межядерного расстояния.

Решение системы не требует каких-то нешкольных навыков, просто MAXIMA удобна, чтобы не запутаться в выкладках. Результаты на картинке ниже.
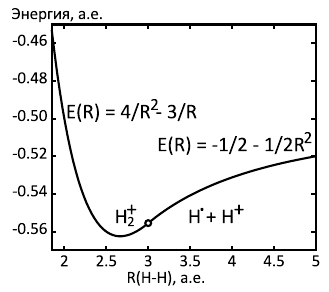
Мы видим, что молекулярный ион термодинамически стабилен относительно распада на протон и атом водорода. Энергия разрыва связи составляет 1/16 (164 кДж/моль), а длина связи - R=8/3 (1.41 Å). Экспериментальные значения - 255 кДж/моль энергия связи, расстояние - 1.07 Å. Для такой простой модели это более чем хорошее согласие.
Заключение
Сведение квантовомеханической задачи к молекулярной механике фермионов открывает в перспективе легкий и очень быстрый способ моделирования свойств материалов и химических реакций. Простые аппроксимации потенциалов Паули и Гейзенберга, к сожалению, не позволяют добиться высокой точности в предсказании свойств. Пока. Тем не менее, сам подход хорош уже тем, что не требует сложнейшего аппарата квантовой механики для понимания различных химических и физических явлений. Возможно, что кому то следующая мысль покажется крамолой, но я уверен в том, что основы химии можно объяснить без отсылок к квантовой физике. Без разбора уравнения Шредингера, гибридизации, теории резонанса, перекрывания орбиталей и прочего.
Наши серверы можно использовать для разработки и просчета научных экспериментов.
Зарегистрируйтесь по ссылке выше или кликнув на баннер и получите 10% скидку на первый месяц аренды сервера любой конфигурации!
