
Главное:
→ Мнение Чёрча о том, могут ли учёные воспроизвести человеческий интеллект в машине
→ Дискуссия о гражданской науке и идеи открытого согласия в геномной конфиденциальности
→ Краткая диатриба о CRISPR (и обзор иных инструментов генной инженерии)
→ Почему генная терапия – будущее прецизионной медицины
→ Пути к реальному обращению старения
Вы, наверное, знаете учёного Джорджа Чёрча по необычным заголовкам в СМИ, которые так или иначе ссылались на его работы – возвращение мамонта, использование CRISPR в кодировании анимированного GIF в живой ДНК и лечение (или обращение) старения. По его личному мнению профессор Гарвардской Медицинской Школы и Массачусетского Технологического Института говорит вещи, которые кажутся неправдоподобными.
«Многие вещи, которые я говорил, когда был молодым, были проигнорированы или высмеяны людьми в моей собственной лаборатории», – сказал Чёрч. «Сейчас всё иначе, и даже если я говорю нелепые вещи, меня не осмеивают. И даже самые нелепые вещи имеют серьёзную версию».
То, что делает Чёрча достойным заголовка, – редкое сочетание характеристик: он является пионером в науке, защитником «гражданской науки», а его внешний вид – высокий, в очках, с волнистыми седыми волосами и большой серой бородой – он похож на Альберта Эйнштейна, Дока Брауна и Чарльза Дарвина.
Именно эти первые две характеристики заставили нас посетить Чёрча в его лаборатории в Гарвардской Медицинской Школе в конце 2017 года. Сочетание научного вклада и способности привлекать публику великими идеями редко встречается у учёных. Вклад Чёрча включает в себя, среди прочего, разработку первых методов прямого секвенирования генома и концепций, которые закладывают основу для секвенирования «следующего поколения» (то есть, что позволяет последовательно и быстро секвенировать целые геномы) и первое использование CRISPR / Cas9 для редактирования генов в стволовых клетках человека.
Помимо профессора Генетики Гарвардской медицинской школы и профессора медицинских наук и технологий в Гарварде и Массачусетском технологическом институте, Чёрч руководит или консультирует в десятках компаний (секвенирование, диагностика, терапия, некоммерческие организации и прочее); он является основателем Wyss Institute for Biologically Inspired Engineering, где он возглавляет направление синтетической биологии; он получил несколько наград, включая премию Бауэра и премию за достижения в области науки и был избран в Национальную Академию Наук.
Когда мы пришли, Чёрч и его команда из почти 100 членов лаборатории, стажёров и приглашённых учёных работали над проектами, такими как генно модифицированные свиньи, чьи органы могли бы трансплантироваться людям, изменение диких видов для ликвидации малярии и болезни Лайма и создание клеток, устойчивых ко всем вирусам. Мы говорили об этих проектах и их влиянии на здоровье людей. В то время как Чёрч проявлял свою обычную открытость и дружелюбие, позволяя нам быть как дома в лаборатории – он посоветовал нам избегать пятого этажа здания, не обозначенного на панели кнопок лифта.
«Мы шутим, что пятый этаж за рамками нашего мира – сказал он. «Люди говорят, что на нём мамонты и неандертальцы. Я не могу ни подтвердить, ни опровергнуть этот слух».

Джордж Черч в Гарвардской медицинской школе в Бостоне, Массачусетс
Перед началом чтения: глоссарий
Гражданская наука: широко определяется как участие общественности в научных исследованиях.
Открытое согласие: идея, относящаяся к геномной конфиденциальности. С открытым согласием участники, которые делятся своими данными, признают риски, раскрывая информацию о себе.
Синтетическая биология: генная инженерия, которая использует преимущества иных сфер, таких как электрическая, механическая инженерия и гражданское строительство, и в то же время использует широкий набор инструментов и ресурсов из дикой природы (например, CRISPR).
Геномная инженерия: подмножество синтетической биологии, включающее сборку целой хромосомы из естественных геномных последовательностей.
Гомологичная рекомбинация: обмен цепями ДНК похожей или идентичной нуклеотидной последовательности.
Секвенирование следующего поколения: общий термин для нынешней технологии секвенирования ДНК, позволяющей быстро секвенировать целые геномы.
Факторы транскрипции: белки, регулирующие транскрипцию генов.
Олигонуклеотиды: короткие молекулы ДНК или РНК.
Нуклеазы: ферменты, которые разрезают нуклеиновые кислоты (ДНК и РНК). Они играют роль в естественном механизме восстановления ДНК клетки и являются важными инструментами в редактировании генома.
Гражданская наука, генная терапия и обращение старения
EH: Я хочу начать с вопроса, который привлёк внимание общественности. В подкасте с вашим коллегой, профессором Массачусетского Технологического Института и Future of Life Institute, Максом Тегмарком, он обсудил природу сознания, сверхчеловеческого ИИ, и зависит ли интеллект от носителя. Расскажите всё, что знаете, у нас будут супер умные машины?
Чёрч: Я склонен скептически относиться. Я думаю, что есть давний мем или идея, что мы можем воспроизвести наш интеллект в машине. В частности, индивидуальный интеллект, подобный вашему или моему, в индивидуальной машине, а не какую-то общую машину, которая может добавлять числа или воспроизводить фильмы.
В моей лаборатории редко используются слова «невозможно». Если это краткосрочный, высокий приоритет, вы можете использовать его. Если вы спросите, что является самым умным компьютером в мире, с самой удивительной вычислительной способностью, это мозг человека. Он может делать такие вещи, как выполненные Эйнштейном в 1905 году пять работ по физике, любая из которых могла получить Нобелевскую Премию, и одна из них получила её. Было бы сложно имитировать это с помощью машины.
Это не менее сложно для прочих людей, но дело в том, что люди способны на это – и с мощностью в 20 ватт. Просто, чтобы обыграть человека в простой задаче, например, шахматы или Jeopardy или Go, требуется машина на 100 киловатт. И это очень ограниченная вещь, в которой люди не очень хороши. Это было бы похоже на то, что человек конкурирует с реактивным двигателем. Это не то, к чему люди эволюционировали, поэтому неудивительно, что они не могут этого сделать. Вещи, в которых люди хороши, являются одними из самых ценных вещей: мышление вне ограничений, размышление о будущем, дипломатическое выступление, обучение этике. Мы очень хорошо справляемся с этими познавательными задачами, и мы очень плохо учим им машин.
EH: Причина, по которой существует Endpoints, и почему мы делаем эти интервью, заключается в поощрении участия в науке. Как вы относитесь к роли не-ученого в науке?
Чёрч: Исторически были разные «гражданские науки»: погода, астрономия, садоводство и генеалогия. И я считаю чрезвычайно важным, что у нас есть гражданская наука. Я был вовлечён в DIY биологию с самого начала этого движения в Сан-Франциско, Нью-Йорке и Бостоне.
Нам нужно вдохновлять следующее поколение, как NASA и анимация Disney, вдохновляли меня, когда я был молод. Не менее важно принимать решения во все более технологическом мире. Нам нужно, чтобы наши граждане и руководители были технически подкованными. Они не обязательно должны иметь научные степени – например, как один конгрессмен, Билл Фостер, но если мы не позаботимся заранее, это поставит нас в невыгодное положение.
EH: Одним из ваших основных проектов, поощряющий гражданское участие, является Personal Genome Project. Что это?
Чёрч: Первоначальная цель состояла в том, чтобы предоставить геномы и прочие -омы, и медицинские данные, чтобы учёные могли найти причины и следствия или, по крайней мере, корреляции между средами и генами. Мы также развиваем клеточные терапии, генные терапии, синтетическую биологию; теперь их можно проверить на клетках из PGP, многие из них мои, но они могут быть от кого угодно. Это можно сопоставить с различными наборами данных, которые открыто доступны.
PGP в основном касается измерения, а не модификации, но я думаю, что измерение является важной частью любого исследования. PGP призван обеспечить способ, которым различные исследования могут обмениваться информацией. В принципе, мы можем быть представителями мира: мы даём согласие, и мир может использовать данные и материалы различными способами. Я думаю, что мы единственный биомедицинский исследовательский проект в мире, который даёт людям полное раскрытие, полную публикацию любого аспекта.
Сейчас это международный проект в пяти странах, и, надеюсь, этой осенью мы добавим Китай и Монголию. Нам не нужны все 7,5 миллиардов человек, хотя было бы неплохо. Чем больше тем лучше.
EH: Можете ли вы объяснить концепции полного раскрытия и открытого согласия?
Чёрч: Когда я разрабатывал очередную технологию секвенирования, я понял, что мы можем быстро перейти бактериальных геномов к человеку. И мы это сделали.
Я полагал, что нам нужно будет получить одобрение institutional review board (IRB), чтобы делать что-либо на людях, даже в секвенировании, поэтому я нанял студента-юриста, Дэна Ворхауса, и этика, и мы опубликовали несколько статей по этому вопросу и поняли: вы не могли обещать деидентификацию в мире, где как ДНК, так и ваши черты идентифицируемы; вы не могли обещать, что вашу информацию не украдут в мире Wikileaks, и где почти все медицинские записи можно взломать, потому что они ценны.
Поэтому мы переключились на механизм, в котором вместо того, чтобы делать ложные обещания, мы смягчили последствия настолько, насколько могли, и, по крайней мере, убедились, что люди знают, во что они вникают. Таким образом, открытое согласие всего лишь откровенно с людьми о реальности медицины и жизни в целом, а это то, что ваши данные убегут и будут повторно идентифицированы.
Проблема в том, что если вы соглашаетесь на что-то меньшее, чем полное раскрытие, а затем что-то произошло – данные ушли или их идентифицировали – вы нарушили своё доверие и контракт. Это неприемлемо. Дело не в «Мы постараемся сделать все возможное, чтобы этого не случилось». Это даёт ощущение, что это можно предотвратить. Если бы это можно было предотвратить, Министерство Обороны и Демократическая Партия могли бы предотвратить это, потому что ставки там намного выше, чем у отдельного пациента.
EH: Таким образом, человек может поделиться своим геномом с PGP. В чем преимущество этого?
Чёрч: Во-первых, если у вас есть семейное заболевание, и вы заставляете свою семью заниматься открытием, вполне вероятно, что болезнь получит более высокий приоритет. Вместо того, чтобы лоббировать конгресс за дополнительным финансированием, воспользуйтесь проектом. Ещё личное знание. Некоторые проекты не только не делят ваши данные с прочими учёными, они не разделяют их с человеком, который его пожертвовал, что меня поразило. Идея защитить вас от ваших собственных данных нелепа.
Это возможность быть частью экосистемы учёных и пациентов, которые способны внести свой вклад.
EH: Выполнило ли PGP что-либо?
Чёрч: Мы разработали CRISPR на индуцированных плюрипотентных стволовых клетках из PGP (они были моими клетками), что было первым использованием CRISPR для стволовых клеток человека и фокусировалось на различных альтернативных способах достижения точного редактирования. У нас также есть первый полный набор факторов транскрипции человека. Мы можем по существу превратить клетки кожи в любую клетку в организме. Мы также использовали это для обращения старения, где мы использовали факторы транскрипции для эпигенетического изменения состояния клетки. Все это было в клеточной культуре.
Редактирование генов, четыре способа
CRISPR: инструмент редактирования генома, созданный из системы защиты бактерий от вирусов и плазмид. Вот подробное объяснение.
Мегануклеазы: семейство нуклеаз, полезное в генной инженерии, из-за их более длинной последовательности распознавания, а это означает, что у них меньше шансов на ошибку.
TALEN: Transcriptor Activator-Like Effector Nucleases. Другой инструмент для редактирования, полученный из бактерий. Учёные могут изменить порядок аминокислот в TALEN, чтобы распознать определённую последовательность ДНК.
Lambda Red: также получен из бактерий. В отличие от прочих инструментов редактирования, lambda red не делает двойной разрыв цепи в ДНК. Вместо этого он использует донорную ДНК во время естественного процесса репликации клетки.
EH: Какие возможности даёт нам CRISPR?
Чёрч: Я спокоен о CRISPR. Я пытаюсь преуменьшить его значение, чтобы противостоять обману. Наши крупнейшие, наиболее эффективные и наиболее точные проекты по разработке генома не включают CRISPR. Наш рекорд для CRISPR – и мировой рекорд – 62 изменения сразу в клетках свиней. Наш рекорд для прочих инструментов редактирования генома составляет 62 000 в проекте, и это было сделано с использованием lambda red.
CRISPR не был первым инструментом редактирования генома. Мы и иные группы использовали мегануклеазы, TALEN, lambda red и прочие. У CRISPR много проблем, поэтому один из наших проектов разрабатывает альтернативы. Мы ищем вещи, которые не вызывают двойных разрывов – поскольку это связано с токсичностью и невозможностью получить точное редактирование.
CRISPR является четвёртым основным способом изготовления нуклеаз. CRISPR немного легче, чем TALEN. В каждом случае, когда вы хотите изменить положение в геноме, на который вы нацеливаетесь, вы его заказываете. В одном случае [CRISPR] вы заказываете указывающую РНК, и в ином случае вы заказываете TALEN. И, фактически, TALEN поставляются в комплекте, поэтому, как только у вас будет комплект, вам больше не нужно ничего заказывать. Ты просто капаешь. В некотором смысле вы можете утверждать, что это проще, чем CRISPR, поскольку вам не нужно заказывать лишнее. Но это означает, что они намного сложнее, и вы не можете изготовить их. Таким образом, отличие – простота использования.
Иное различие заключается в том, насколько они эффективны, когда попали в клетку? Иными словами, как только вы попали в клетку, каковы шансы, что вы получите то, что хотите? Если вы хотите что-то выключить, CRISPR довольно эффективен. В некоторых случаях он может быть в два-четыре раза лучше.
Большинство «книжных» людей называют редактированием выключение гена. Это не очень точное редактирование. Точное редактирование – например, у вас есть ген серповидной анемии, и вы хотите изменить A на T. Это точно. Если вы хотите избавиться от гена гемоглобина, CRISPR – ваш инструмент для этого.
Но если вы хотите сделать что-то точное, вы получаете гонку между случайной и точной репарацией двойной цепи. Почему и нужны такие вещи, как lambda red. Для CRISPR вам нужны две нуклеиновой кислоты: направляющая РНК и донорная ДНК. В lambda red, вам просто нужно поставить донорскую ДНК, и это точно, потому что она не делает двойного разрыва. Она вторгается в нормальную репликацию, когда у вас мало однонитевых цепей, и заменяет единичный кусок. (Когда вы копируете ДНК, у вас есть короткие кусочки, которые, естественно, одноцепочечные, она просто привязывается к ним.)
EH: Почему люди в восторге от CRISPR?
Чёрч: Я думаю, что есть тенденция создавать иконы. Логотип Apple не имеет ничего общего с яблоками. За ним стоит электроника, программное обеспечение, дизайн, тестирование, прочность, человеческие факторы, всё это. Но все говорят, что это Apple. То же самое о CRISPR. Это не CRISPR. Это редактирование.
Это моя маленькая диатриба.
EH: Прежде чем мы углубимся в редактирование генов, давайте сделаем большой шаг назад и поговорим о том, что вы делаете в своей лаборатории, в общем.
Чёрч: То, что мы делаем в целом, – развитие преобразующих технологий, в идеале – что-то с удивительной философской составляющей, технологической компонентой c фактором в миллион раз, а не в два, и общественными преимуществами. Вы пытаетесь принять всё это во внимание.
Примеры вещей, в которые мы были вовлечены, включают секвенирование следующего поколения, способное секвенировать геном человека менее чем за $1000; in situ секвенирование, где вы можете увидеть сиквенсы компонент в клетке; написание новых геномов, а не просто редактирование их, а затем использование, чтобы точно и недорого создавать организмы, органы, экосистемы. Многое из того, что мы делаем, связано с безопасностью, ценой и эгалитарным распределением технологий.
EH: Эти преобразующие технологии порой известны под названием «синтетическая биология», а в случае с Wyss – «биологически вдохновлённая инженерия». Что это значит?
Чёрч: Я опишу это так. CRISPR является крошечным подмножеством редактирования. Редактирование – крошечное подмножество геномных технологии. Генная терапия является подмножеством генной инженерии. Инженерия – подмножество синтетической биологии. Синтетическая биология – подмножество биологически вдохновлённой инженерии, которая включает в себя биологическую инженерию, а также вещи, которые на самом деле не биологические или биомедицинские, например, маленькие роботизированные пчёлы и технологии роя.
Вы также можете сказать, что синтетическая биология – это настоящая генная инженерия со всеми преимуществами прочих сфер, таких как электрическая, механическая инженерия и гражданское строительство, но и с её собственными преимуществами: широкий набор инструментов и ресурсов, которые пришли из дикой природы, например CRISPR. Это была очень сложная вещь, и приспособление её от бактерий к млекопитающим было в наших силах. Было сложно, но мы сделали её за год. Если бы мы пытались изобрести CRISPR с нуля из атомов, это было бы намного сложнее.
У нас есть очень сложные наномашины из природы, плюс возможность самостоятельно заниматься эволюцией. С мобильным телефоном или автомобилем у вас может быть один прототип или пара. С помощью биотехнологии вы можете делать триллионы тестов. Вы можете сделать миллиарды прототипов в пробирке и протестировать их одновременно.

EH: Итак, давайте поговорим о редактировании генов. Каковы приложения?
Чёрч: Мы используем его для «очеловечивания» свиней, чтобы мы могли брать их органы. Мы используем его у диких видов, чтобы они были устойчивыми к болезни Лайма и малярии. Нужно немало инженерных усилий, чтобы сделать их устойчивыми, поскольку вы не хотите её угасания. Вы хотите, чтобы мыши или москиты оставались устойчивыми. Самая экстремальная форма редактирования делает хозяина устойчивым ко всем вирусам, даже тем, которые вы никогда раньше не видели. Оказывается, вирусы не имеют собственного генетического кода. Они зависят от хозяина. Вы можете изменить хозяина таким образом, чтобы не навредить ему, но вирус даже не может начать развиваться в нём.
Мы показали это изменяя генетический код одного промышленного микроорганизма, и теперь мы расширяем приём на несколько организмов и более жёсткие тесты на устойчивость ко всем вирусам.
EH: В этом году FDA одобрило первую генную терапию, как вы сказали, подмножество генной инженерии. Почему генные терапии ценны?
Чёрч: Генная терапия особенно привлекательна для нас, потому что вы можете перейти от теории к гипотезе и к терапии почти мгновенно. Вам не нужно открывать малую молекулу. Малая молекула – непрямой подход. Если вы знаете вашу молекулярную цель, вы не обязательно знаете состав молекулы, влияющей на неё. Если вы знаете феномен, вы не обязательно знаете вашу цель или состав молекулы. Если у вас есть теория, в которой вы знаете механизм, вы можете сразу перейти к генной терапии без каких-либо проблем. Мы перейдём от теории, которая может работать в каком-то простом организме, к испытанию либо в человеческих органоидах, либо у мышей, а затем на собак, и на людей.
Другим аргументом в пользу генной терапии является факт – что в принципе, вы можете навсегда изменить клетку. Это как закон Ньютона: движение неизменно, пока вы что-то не сделаете. Он означает, что вам не нужно принимать таблетку один или несколько раз в день. Потенциальное преимущество, но оно не реализовано, ибо на рынке не так много генных терапии. Скоро будут. Я вполне уверен, что генные терапии станут одними из самых точных и безопасных механизмов, которые у нас есть, потому что они легко программируемы. Их легко сделать умными: куда они доставлены, что они делают, логику, которую они дважды проверяют, что они делают правильные вещи в нужном месте и в нужное время. [Вот краткое описание того, как они работают.]
Преимущество умного препарата, не зависящее от человека, которому нужно помнить многое. Вы пьёте таблетку вслепую, если вы не берете образцы крови и не анализируете их на компьютере, который говорит вам, когда и что делать. Большинство таблеток принимаются единообразно. Я получаю ту же дозу, что и вы, независимо от нашего веса, времени суток, независимо от моего стресса и прочее. Мы стремимся к прецизионной медицине, но мы ещё не пришли к ней. Генная терапия – наш лучший шанс на прецизионную медицину. Он автоматизирован на наноуровне.
EH: Как можно проводить точные генные терапии?
Чёрч: Они могут быть доставлены внутривенно в системной доставке. У нас есть некоторые доказательства того, что мы можем получить по крайней мере небольшие уровни в нескольких разных тканях. Они могут быть внутримышечными, или в сетчатку, мозг, через кишечник. Это может быть даже таблетка. Ей придётся пройти через желудочную сок, затем через кишечный барьер, а затем, если вы хотите попасть в мозг, она должна пересечь ещё один барьер к мозгу.
EH: Я слышал, что вы работаете над генной терапией обращающей старение, поэтому давайте поговорим о старении. Существует ли приемлемая причинно-следственная теория старения?
Чёрч: Существуют гипотезы и разные школы мысли. Это не так зрело, чтобы был консенсус. Относительно мало интересных областей биологии, где есть консенсус. Есть школа, говорящая, что это всё повреждение, и вы должны восстановить нанесённый урон. Есть ещё одна школа, о регулировании и эпигенетике, и если вы получите клетку в правильном эпигенетическом состоянии, тогда она может сама восстановить ущерб; молодая клетка намного более эффективна в репарации.
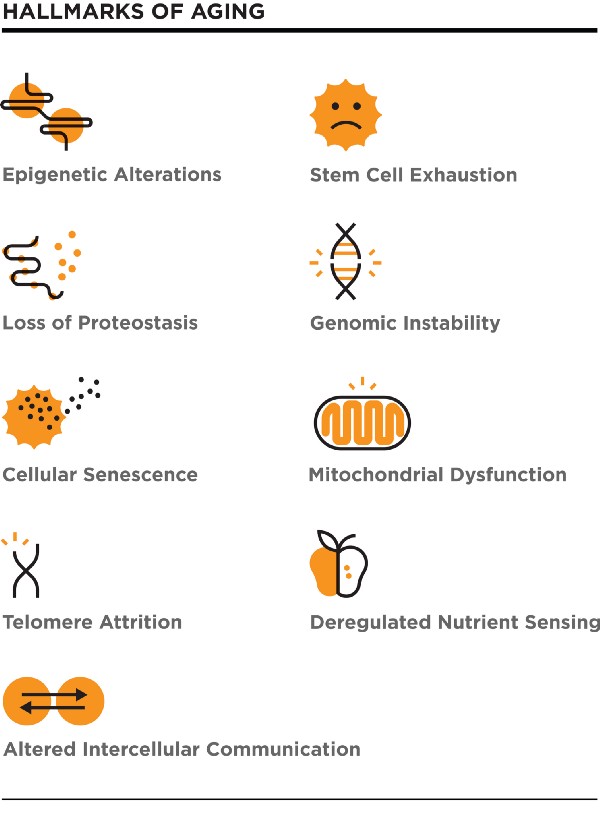
Также есть Hallmarks of aging – около девяти компонент – и, возможно, вы должны исправить все их для омоложения. Мне нравится эта версия, где они говорят о конкретных биологических механизмах. Если вы будете бороться с ними или используете их, вы получите лучший шанс на лечение старения.
Итак, вопрос: «почему» мы стареем намного менее полезен, чем его механизмы, но с некоторой интуицией, почему механизмы старения именно таковы, он может помочь вам манипулировать ими. И очень часто вы хотите манипулировать ими неестественным образом, и это требует более глубокого понимания. Если вы пытаетесь сделать что-то совершенно естественное, ваш протокол ясен. Если вы обнаружите, что в западном мире мы ели много мраморной коровы, которой не было в древние времена, всё, что вам нужно сделать, это избавиться от мраморной коровы, и всё. С другой стороны, если вы пытаетесь заставить людей жить более 150 лет, для этого нет прецедента. Вы не можете заглянуть в книги по истории и найти, что люди ели, когда они жили как Мафусаилы, потому что этого не было.
Я думаю, что существует определённая тенденция путать надежду с реальностью, что есть источник молодости, какая-то вода, которую вы можете выпить, какую-нибудь еду, которую вы можете съесть, и это решило бы проблему.
EH: Решите проблему, решите старение. Как это будет достигнуто?
Чёрч: Конечно, если бы вы смогли исправить все девять признаков одновременно, это было бы хорошо. Обращение старения было продемонстрировано у простых животных. Некоторые люди отклонят их как слишком простые – поскольку у них очень короткая жизнь, неудивительно, что вы можете заставить их жить дольше. Но я думаю, что совершенно ясно, что старение запрограммировано в некотором смысле. Не так, что вы были запрограммированы умереть в определённом возрасте, но лень эволюции привела к тому, что ваша программа не избегала смерти.
В течение эволюционного времени, чтобы использовать аналогию, было нецелесообразно инвестировать много вашей драгоценной пищи, чтобы жить дольше, потому что вы всё равно будете съедены волком. Теперь у нас много избыточной пищи, и вместо того, чтобы пускать её на ожирение, давайте пустим её на то, чтобы пожить дольше, потратив лишние АТФ на репарацию и омоложение. Это легко делают 20-летние, но после 60 вы не очень хороши в них.
EH: Как вы собираетесь исправлять Hallmarks?
Чёрч: Один из моих бывший поcтдоков, João Pedro de Magalhães, имеет базу данных, которую многие исследователи используют под названием GenAge. Она содержит около 304 генов, по которых имеются данные у людей, а также червей, мух и дрожжей и прочее. Идея состоит в том, чтобы взять подмножество генов, которые, как было продемонстрировано, играют роль в долголетия или обращении старения в небольших организмах и перенастроить их на использование в генной терапии. Вы меняете ген на долговечную версию, что требует введения его в зародышевую линию, и самом деле не является хорошей стратегией для людей, потому что большинство из нас, которые хотят долголетия, уже выросли, и мы переконфигурируем её как генную терапию при помощи адено-ассоциированного вируса. Это аддитивная генная терапия, а не субтрактивная, такая как CRISPR.
Как я уже говорил, очень легко перейти из теории в генную терапию. Мы поставили более высокий приоритет там, где нам не нужна 100% доставка в каждую клетку. Это в будущем. Мы начинаем с вещей, которые не являются независимыми клетками или могут так или иначе влиять больше, чем на одну клетку.
EH: Как обращение старения выглядело бы для человека?
Чёрч: На самом деле оно приводит ваши биомаркеры к более юному виду. Многие из них являются молекулярными, но они также физиологичны: сила, память, устойчивость к инфекции, список можно продолжить. Если у вас есть что-то действительно системное, должна быть корреляция с тем, как вы выглядите.
EH: Как далеко оно?
Чёрч: Простой ответ, я не знаю. Вероятно, в ближайшие год-два мы увидим первые испытания на собаках. Если они сработают, человеческие испытания пройдут ещё через два года и завершатся через восемь. Как только вы получите первые хорошие результаты – у вас заработает цикл положительной обратной связи.
EH: И вы на самом деле работаете над испытаниями для собак.
Чёрч: Да, и конкретная модель собаки, которую мы используем, имеет проблему с сердечными заболеваниями. Rejuvenate Bio всё ещё является полу-скрытой компанией, в инкубационном режиме, но испытания не секрет. Собаки сами по себе являются рынком. Это не просто большой организм, близкий к человеку. Они то, за что люди будут платить. И в FDA разрешение намного быстрее для собак, чем для людей – немногим более года против девяти лет или около того. Мы будем проводить испытания на собаках, и это будет продукт, и он оплатит расширение масштаба на человеческие испытания.
EH: Нужно ли FDA классифицировать старение как болезнь, чтобы лечить его?
Чёрч: Нет, они делают то, что им нужно делать. Если у вас на самом деле есть что-то, что может привести к обращению старения, они одобрят его. Вы будете использовать его в обычных терминах, но он может иметь дополнительные преимущества. Иными словами, если у вас есть что-то, что устраняет одну проблему и ещё кучу других, вам не нужно размещать их на этикетке. FDA не останавливает вас за то, что вы используете вещи не по назначению или вылечиваете сразу две вещи.
EH: Что вы думаете об испытаниях метформина и иных препаратов и добавок?
Чёрч: Мы должны пробовать все пути. Хотя мои исследования не фокусируются на малых молекулах, я рад, что люди смотрят на них. Мы не изучаем малые молекулы, потому что считаем, что есть много вещей, которые нужно исправить на очень фундаментальном уровне, и для этого потребуется много малых молекул. Даже производство одного успешного препарата – это предприятие на миллиард долларов, которое лучше всего делать в фармацевтической компании. По нашему опыту вы можете делать много генных терапий за раз и по приемлемой цене.
Это не просто стоимость. Я думаю об эффективности и расширяемости. Общий опыт заключается в том, что чем мощнее лекарство, тем сложнее болезнь, с которой вы имеете дело, а старение – конечно, очень сложная болезнь, ибо есть 100% шанс, что вы умрёте от него, если что-то не случится раньше. Мало вероятно, что у вас будет простой коктейль из соединений, которые работают в широком диапазоне у людей и не требуют механизмов обратной связи.


EH: Дженнифер Дудна, со-изобретатель CRISPR, в своей книге «A Crack in Creation: Gene Editing and the Unthinkable Power to Control Evolution» говорила о возможности того, что мы расширим наше экономическое неравенство на медицину с помощью редактирования генов. Что ты об этом думаете?
Чёрч: Мы снизили стоимость и цену на многие вещи, включая чтение генома, в три миллиона раз. В создании синтетических олигонуклеотидов, даже больше. В редактировании немного скромнее: возможно, в 100 раз. Но я думаю, что мы сможем сделать больше. Я не вижу какой-либо особой причины, почему биологию нельзя делать недорого. Она сводится к тому, сколько стоят клинические испытания, и над какой массой населения вы можете амортизировать расходы на испытания. Если у вас есть небольшое испытание, которое работает на огромном населении, вы быстро вернёте свои деньги.
А старение, это потенциальный рынок в 7,5 миллиардов человек, в отличие от того, что лечит, скажем, особую глазную болезнь, такую как LCA, которую мы делаем в Editas, которая может быть одной на миллион. Один из способов снизить цену – держать исследования небольшими, имея что-то с высокой внутренней безопасностью и нужное большому числу людей. Я занимаюсь всем вышеуказанным. Но, конечно, история фармацевтических препаратов противоположна. Затраты продолжают увеличиваться. Я думаю, всё может измениться.
EH: Со всеми существующими и находящимися на горизонте средствами защиты здоровья, каков идеальный профиль личной информации, если вы хотите максимизировать своё здоровье?
Чёрч: Я думаю, что для диагностических целей ваш унаследованный геном является самым ценным, и диагностика гораздо более экономически эффективна, чем терапия, потому что терапии – генные терапии, их цены составляют порядка миллиона долларов, и немногие из них были одобрены. Диагностика действительно недооценена и недорога. Пять процентов младенцев рождаются с очень серьёзным наследственным генетическим заболеванием, и его можно избежать. Вы можете заранее использовать контрацепцию, или, если это не противоречит вашей вере, с помощью аборта, но вы можете избежать этих очень серьёзных, болезненных и дорогостоящих заболеваний.
В идеале это делается целым геномным секвенированием, а не обычными SNP, например, как в 23andMe. Они не занимаются диагностикой полного набора рецессивных и доминирующих менделевских заболеваний, но такие компании, как Veritas, – делают именно это. Раньше его цена была три миллиарда долларов, теперь $999, которые могут спасти вас от наследственной болезни, и это вообще не проблема.
Для микробиома полная последовательность генома всех бактерий была бы дорога и, вероятно, чрезмерна, но никто на самом деле не добивался такого высокого уровня, это было бы слишком много. И я не думаю, что анализ микробиома был бы таким ценным, но терапия, такая как фекальные трансплантаты для лечения Сlostridium difficile, была очень ценна.
Иногда диагностика важна, иногда лечение. Иногда ничего из них не готово к использованию.
EH: Почему больше людей не заказывают полное секвенирование генома?
Чёрч: В США у нас очень странные отношения с медициной, которые отличаются от любого другого продукта, который мы покупаем. Если вы хотите обновить свой мобильный телефон, автомобиль или дом, вы его покупаете. Вы не говорите: «Я собираюсь подождать, и посмотреть – получу ли компенсацию?» Это просто безумие, что мы должны получать компенсацию. Подход, ломающий инновации. Вы можете пройти несколько циклов высококонкурентных инноваций в сотовых телефонах, потому что каждый покупает их на основе импульсов, потребностей, ценности – но в медицине вы покупаете то, что возмещается.
Таким образом, проблема – убедить людей платить из своего кармана в системе, где большинство медицинских услуг распределено либо правительством, либо страховой компанией. Страхование изначально предназначалось для экстренного случая, когда человек не мог себе ничего позволить. Оно не было предназначено для покупки упаковки таблеток. Это явно нуждается в исправлении.

